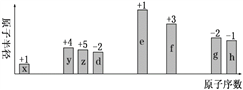
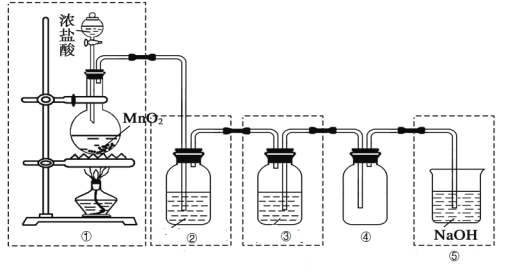
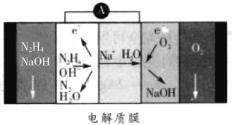
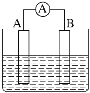
题目内容
【题目】化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验装置与实验目的对应的是( )
|
|
|
|
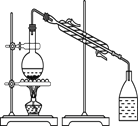
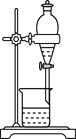
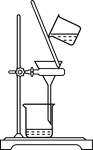
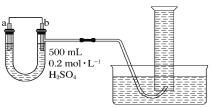
A用海水制蒸馏水 | B将碘水中的碘单质与水直接分离 | C除去Fe(OH)3胶体中的FeCl3 | D稀释浓硫酸 |
A.AB.BC.CD.D
【答案】A
【解析】
A.海水中含有盐,因此采用蒸馏的方法可以得到蒸馏水,故A正确;
B.碘水属于溶液,不分层,不能用分液的方法进行分离,故B错误;
C.胶体粒子不能透过半透膜,溶液中的粒子可以透过半透膜,因此除去Fe(OH)3胶体中的FeCl3可以采用渗析的方法进行分离,故C错误;
D.浓硫酸溶于水放出大量的热,因此不能在容量瓶内稀释浓硫酸,应该在烧杯中进行,以防发生危险,故D错误;
故答案选A。

【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。
①该反应在常温下_______(填“能”或“不能”)自发进行。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是____(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时,断裂2 mol H—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
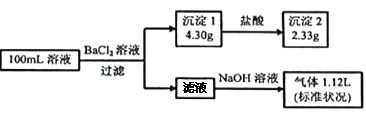
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=________(取小数点后两位,下同)。
②该反应的正反应为________(
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。
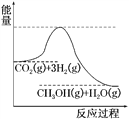
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2