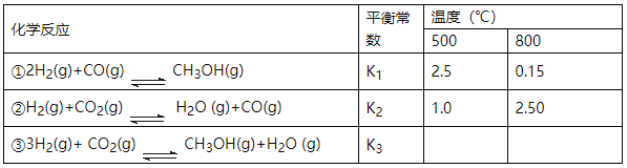
题目内容
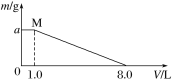
【题目】将FeCl3、CuCl2混合溶液加入一定质量的铁粉中充分反应,所加混合溶液的体积与反应后剩余固体质量如图所示。已知原混合溶液中Cu2+浓度为0.140 mol·L-1,经检测M点时溶液中无Cu2+。
求:(1)c(FeCl3)=______mol·L-1。
(2)铁粉的质量为____g。
【答案】0.04 8.96
【解析】
铁离子的氧化性大于铜离子,铁离子首先氧化金属铁,经验测M点时溶液中无铜离子,固体质量不变,根据2Fe3++Fe=3Fe2+、Cu2++Fe=Cu+Fe2+可知,消耗铁的质量等于析出铜的质量,据此分析作答。
根据上述分析可知:
(1)1L溶液内氯化铜的物质的量为0.140 mol,设铁离子的物质的量为x mol,则(0.140+0.5x)mol![]() 56g/mol=0.140
56g/mol=0.140![]() 64g/mol,解得x=0.04,则c(FeCl3)=
64g/mol,解得x=0.04,则c(FeCl3)=![]() =0.04 mol·L-1,故答案为:0.04;
=0.04 mol·L-1,故答案为:0.04;
(2)加入8.0 L溶液时固体全部溶解,说明铁只与铁离子反应,则铁离子的物质的量为0.04 mol·L-1![]() 8.0 L=0.32 mol,则根据2Fe3++Fe=3Fe2+可知,铁的物质的量为
8.0 L=0.32 mol,则根据2Fe3++Fe=3Fe2+可知,铁的物质的量为![]()
![]() 56g/mol=8.96 g,故答案为:8.96。
56g/mol=8.96 g,故答案为:8.96。

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目