题目内容
【题目】按要求填空:
(1)有四种物质:①氧化铁 ②硫酸 ③碳酸氢钠 ④氢氧化钠
①属于盐的是________(填序号),写出这种物质在水溶液中的电离方程式__________。
②上述物质中有一种与其他三种物质均能反应,此物质是__________(填序号)。
(2)酸性条件下,次磷酸(H3PO2)可发生下列反应而用于化学镀银。
口Ag++口H3PO2+口 =口Ag+口H3PO4+口
试回答下列问题
①该反应的氧化产物是_________。
②请将反应物和生成物补充完整并配平,并用双线桥法标出电子转移的数目。______
③若反应中生成10.8gAg,则转移电子的数目约为________。
【答案】③ NaHCO3=Na++HCO3- ② H3PO4 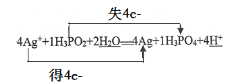 0.1NA
0.1NA
【解析】
(1)①金属阳离子和酸根阴离子构成的化合物为盐;
②硫酸和金属氧化物、碱、碳酸盐反应;
(2)反应中Ag+→Ag,化合价降1,反应中H3PO2→H3PO4,+1价的P化合价升高为磷酸分子中+5价,化合价升高4,依据得失电子守恒,原子个数守恒配平方程式。
(1)①:①氧化铁是氧化物,②硫酸是酸,③碳酸氢钠为盐,④氢氧化钠为碱,碳酸氢钠是强电解质水溶液中完全电离,电离方程式:NaHCO3=Na++HCO3-;
②上述物质中有一种与其他三种物质均能反应的物质是硫酸,和氧化铁反应生成硫酸铁和水,和碳酸氢钠反应生成硫酸钠、二氧化碳和水,和氢氧化钠反应生成硫酸钠和水;故答案为:②;
(2)①该反应的氧化产物是H3PO4;
②反应中Ag+→Ag,化合价降1,反应中H3PO2→H3PO4,+1价的P化合价升高为磷酸分子中+5价,化合价升高4,要使氧化剂得到电子总数等于还原剂失去电子总数,则Ag+系数为4,H3PO2系数为1,依据原子个数守恒,反应方程式:4Ag++H3PO2+2H2O═4Ag+H3PO4+4H+,用双线桥法标出电子转移的数目: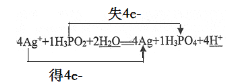 ;
;
③由反应可知生成4mol银转移4mol电子,若反应中生成10.8gAg,物质的量为0.1mol,则转移电子的数目约为0.1NA。