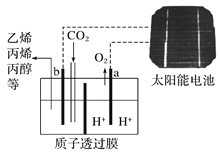
��Ŀ����
����Ŀ��������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�

������Ͳ��ȡ50mL0.50mol��L-1���ᵹ��С�ձ��У���������¶ȣ�������һ��Ͳ��ȡ50mL0.55mol��L-1NaOH��Һ��������һ�¶ȼƲ�����¶ȣ��۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶ȣ��ش��������⣺
��1��Ϊʲô����NaOH��ҺҪ�Թ���____________________��
��2������NaOH��Һ����ȷ������________(�����)��
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������________(�����)��
A�����¶ȼ�С�Ľ���
B���ҿ�ӲֽƬ�ò���������
C����������ձ�
D���������¶ȼ��ϵĻ��β������������ؽ���
��4���ֽ�һ������ϡ����������Һ��ϡ����������Һ��ϡ��ˮ�ֱ��1L1mol��L-1��ϡ����ǡ����ȫ��Ӧ���䷴Ӧ�ȷֱ�Ϊ��H1����H2����H3�����H1����H2����H3�Ĵ�С��ϵΪ________��
��5��________(��ܡ����ܡ�)��Ba(OH)2��Һ�������������������Һ�����ᣬ������_____________��
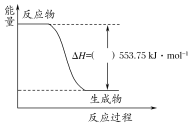
���𰸡�ȷ�����ᱻ��ȫ�к� CD��H1����H2����H3����H2SO4��Ba(OH)2��Ӧ����BaSO4�����������Ȼ�Ӱ�췴Ӧ�ķ�Ӧ��
��������
��1��ʵ���У�����NaOH�Թ�����ԭ����ȷ�����������ᷴӦ��ȫ��
��2����������������Һʱ������һ����Ѹ�ٵĵ��룬Ŀ���Ǽ���������ɢʧ�����ּܷ��ε�������������Һ������ᵼ������ɢʧ��Ӱ��ⶨ������ʴ�ΪC��
��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ���������ǣ��������¶ȼ��ϵĻ��β������������ؽ������¶ȼƲ����������裬�ҿ�ӲֽƬ�ò���������ᵼ��������ʧ����������ձ�����ʹҺ�彦�����ʴ�ΪD��
��4���к�����ǿ����ǿ��ϡ��Һ��ȫ��Ӧ����1molˮ�ų���������һ������ϡ����������Һ��ϡ����������Һ��1L 1molL-1��ϡ����ǡ����ȫ��Ӧ������ͬ��һˮ�ϰ���������ʣ����ڵ���ƽ�⣬������������ȵģ�ϡ��ˮ��1L 1molL-1��ϡ����ǡ����ȫ��Ӧ�ų����������٣������ڷ�Ӧ�ʱ��Ǹ�ֵ�����ԡ�H1����H2����H3��
��5��������Ba(OH)2��Һ��Ӧ��������ˮ�⣬��������BaSO4�������÷�Ӧ�е������Ȼ�Ӱ�췴Ӧ�ķ�Ӧ�ȣ����Բ�����Ba(OH)2��Һ���������NaOH��Һ��������к��ȡ�

����Ŀ����ϵΪԪ�����ڱ��еڢ�B�塢ԭ������Ϊ57��71��Ԫ�ء�
(1)��(Dy)�Ļ�̬ԭ�ӵ����Ų�ʽΪ[Xe]4f106s2��������(Dy)ԭ����Χ�����Ų�ͼ��_____��
(2)���³��������籵ͭ�������к���Cu3+����̬ʱCu3+�ĵ����Ų�ʽΪ_______________��
(3)�۲�����������ϵԪ�صĵ��������ݣ��ж����п�����ʾ+3�۵�Ԫ����_______(��Ԫ������)��
������ϵԪ�صĵ�����(��λ��kJ��mol-1)
Ԫ�� | I1 | I2 | I3 | I4 |
Yb(��) | 604 | 1217 | 4494 | 5014 |
Lu(��) | 532 | 1390 | 4111 | 4987 |
La(��) | 538 | 1067 | 1850 | 5419 |
Ce(��) | 527 | 1047 | 1949 | 3547 |
(4)Ԫ����(Ce)�����γ������(NH4)2[Ce(NO3)6]��
���������������Ԫ�أ��縺���ɴ�С��˳��Ϊ_______________(��Ԫ�ط��ű�ʾ)��
��Ԫ��AlҲ�����Ƴɼ��������̬�Ȼ������ӱ�ʾΪ(AlCl3)2��������Al ԭ���ӻ���ʽΪ________��������������ѧ��������______________(����ĸ)��
a.���Ӽ� b.���Լ� C���Ǽ��Լ� d.��λ��
(5)PrO2(��������)�ľ���ṹ��CaF2���ƣ���������ԭ��λ�����ĺͶ��㣬��PrO2(��������)�ľ�������______����ԭ�ӣ���֪��������Ϊa pm���ܶ�Ϊ��g��cm-3��NA=________ (�ú�a�����Ĵ���ʽ��ʾ)��
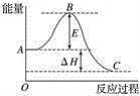
����Ŀ������������Ԫ��A��B��C��D��E��ԭ��������������A��B��C�ĵ����ڳ����¶�����̬��Cԭ�������������ǵ��Ӳ�����3����C��Eλ��ͬ���塣1 mol DAx��������A2C��Ӧ����44.8 L����״����G���塣A��B�ĵ�������ΪG��T�����ܱ������г���һ������G��T��һ�������·�����ӦG+T��W��δ��ƽ������ø����ʵ�Ũ�������ʾ��
���� | T | G | W |
10 minʱ��c/(mol/L) | 0.5 | 0.8 | 0.2 |
20 minʱ��c/(mol/L) | 0.3 | 0.2 | 0.6 |
�ش��������⣺
��1��A��B��C����ɼȺ����Ӽ��ֺ����ۼ��Ļ�����û�����Ļ�ѧʽΪ_________��
��2��B��C��D��E�ļ������У����Ӱ뾶�ɴ�С����Ϊ__________�������ӷ��ű�ʾ����
��3��J��L����A��B��C��E����Ԫ����ɵ����ֳ�����ʽ�Σ�J��L��Ͽɲ����д̼�����ζ�����壬д����������Һ������Ӧ�����ӷ���ʽ__________��J��L����ʹ���Ը��������Һ��ɫ����_______���ѧʽ����
��4��B2A4C2����ȼ�ϵ�طŵ�Ч�ʸߡ��õ�طŵ�ʱ����B2��A2C��������ӦʽΪ________����ع���һ��ʱ��������Һ��pH_____����������������С����������������
��5����A��B��C��D����Ԫ����ɵĵ��ʡ���������һ�������µ�ת����ϵ�����������Ͳ�����ʡ�ԣ���ͼ��ʾ����֪M���¡�
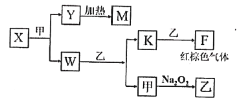
��X�ĵ���ʽΪ______��
����֪W���ҷ�Ӧ����K�ͼ���ij��Ҫ������������֮һ������䷴Ӧ���ʵķ���������Ӧ��Ũ�ȡ�����ѹǿ�⣬����______��______��