题目内容
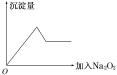
【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1 mol DAx与足量的A2C反应生成44.8 L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T→W(未配平),测得各物质的浓度如表所示。
物质 | T | G | W |
10 min时,c/(mol/L) | 0.5 | 0.8 | 0.2 |
20 min时,c/(mol/L) | 0.3 | 0.2 | 0.6 |
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,该化合物的化学式为_________。
(2)B、C、D、E的简单离子中,离子半径由大到小排序为__________(用离子符号表示)。
(3)J、L是由A、B、C、E四种元素组成的两种常见酸式盐,J、L混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式__________;J、L中能使酸性高锰酸钾溶液褪色的是_______(填化学式)。
(4)B2A4C2碱性燃料电池放电效率高。该电池放电时生成B2和A2C,正极反应式为________;电池工作一段时间后,电解质溶液的pH_____(填“增大”“减小”或“不变”)。
(5)由A、B、C、D四种元素组成的单质、化合物在一定条件下的转化关系(部分条件和产物已省略)如图所示,已知M耐高温。
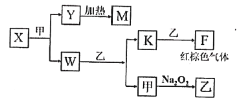
①X的电子式为______。
②已知W与乙反应生成K和甲是某重要化工生产步骤之一,提高其反应速率的方法除增大反应物浓度、增大压强外,还有______、______。
【答案】NH4NO3或NH4NO2 S2-> N3->O2->Mg2+ HSO3-+H+=SO2↑+H2O NH4HSO3 O2+2H2O+4e-=4OH- 减小 ![]() 升高温度 使用催化剂
升高温度 使用催化剂
【解析】
C原子最外层电子数是电子层数的3倍,即C为O,C和E位于同主族,即E为S,A、B、C的单质在常温下都呈气态,且原子序数依次增大,即A为H,B为N,A的单质为G,即G是H2,B的单质为T,即T为N2,化学反应中,各物质的化学反应速率之比等于化学计量数之比,再结合题给表格数据,得3G+T=2W,即W为NH3,1molDAx与H2O反应生成44.8LH2气体,氢气的物质的量为![]() =2mol,DHx中H显-1价,失电子,则x=2,D显+2价,其五种元素的原子序数依次增大,则D为Mg;
=2mol,DHx中H显-1价,失电子,则x=2,D显+2价,其五种元素的原子序数依次增大,则D为Mg;
C原子最外层电子数是电子层数的3倍,即C为O,C和E位于同主族,即E为S,A、B、C的单质在常温下都呈气态,且原子序数依次增大,即A为H,B为N,A的单质为G,即G是H2,B的单质为T,即T为N2,化学反应中,各物质的化学反应速率之比等于化学计量数之比,再结合题给表格数据,得3G+T=2W,即W为NH3,1molDAx与H2O反应生成44.8LH2气体,氢气的物质的量为![]() =2mol,DHx中H显-1价,失电子,则x=2,D显+2价,其五种元素的原子序数依次增大,则D为Mg;
=2mol,DHx中H显-1价,失电子,则x=2,D显+2价,其五种元素的原子序数依次增大,则D为Mg;
(1)H、N、O三种元素组成既含有离子键又含共价键的化合物,该化合物为离子化合物,即该化合物为铵盐,化合物有NH4NO3、NH4NO2;
(2)四种元素的简单离子是N3-、O2-、Mg2+、S2-。S2-有3个电子层,半径最大;N3-、O2-、Mg2+三种离子的核外电子排布相同,核电荷数越大,半径越小;离子半径大小顺序是r(S2-)>r(N3-)>r(O2-)>r(Mg2+);
(3)四种元素组成化合物为酸式盐,即铵盐,该铵盐化学式为NH4HSO4、NH4HSO3,两种溶液发生的离子方程式为HSO3-+H+=SO2↑+H2O;NH4HSO3中S的化合价为+4价,以还原性为主,能使酸性高锰酸钾溶液褪色;
(4)B2A4为N2H4,C2为O2,N2H4与O2反应方程式为N2H4+O2=N2+2H2O,负极反应式为N2H4+4OH--4e-=N2↑+4H2O,正极反应式为O2+2H2O+4e-=4OH-,根据总反应,产生H2O,即溶液的碱性减弱,pH减小;
(5)F为红棕色气体,即F为NO2,K为NO,联系氨的催化氧化反应,W为NH3,乙为O2,甲为H2O,M为耐高温的物质,M可能为Al2O3,也可能为MgO,根据转化关系,X为Mg3N2,Y为Mg(OH)2,Z为MgO,①Mg3![]() ;
;
②NH3的催化氧化发生的反应方程式为4NH3+5O2 ![]() 4NO+6H2O,提高反应速率的方法是升高温度、使用催化剂等。
4NO+6H2O,提高反应速率的方法是升高温度、使用催化剂等。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案