题目内容
【题目】(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O过程中的能量变化图,请在图中的括号内填入“+”或“-”。
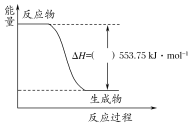
②写出表示丙烷燃烧热的热化学方程式:____________________________________________。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJmol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJmol-1。
请回答下列问题:
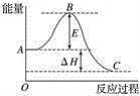
①图中ΔH=______kJmol-1。
②已知单质硫的燃烧热为296 kJmol-1,计算由S(s)生成1 mol SO3(g)的ΔH=______ kJmol-1。
【答案】-C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2215.0 kJ·mol-1 -198-395
【解析】
(1)①根据图中信息:反应物的能量高于生成物的能量,此反应是放热反应,所以焓变是负值,故答案为:—;
②燃烧热的是指完全燃烧1mol丙烷生成稳定产物二氧化碳气体和液态水所放出的热量,图中是一定量丙烷完全燃烧生成CO2和1mol H2O(l)的能量,1mol丙烷完全燃烧生成CO2和4mol H2O(l)的能量为:553.75kJ/mol×4=2215.0 kJ/mol,所以丙烷燃烧热的热化学方程式为C3H8(g)+5O2(g)═3CO2(g)+4H2O(l) △H=-2215.0 kJ/mol,故答案为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l) △H=-2215.0 kJ/mol.
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJmol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198kJmol-1,故答案为:-198;
(3)已知①S(s)+O2(g)=SO2(g)△H1=-296KJmol-1,②SO2(g)+![]() O2(g)=SO3(g)△H2=-99kJmol-1;利用盖斯定律将①×3+②×3可得S(s)+3/2O2(g)=SO3(g)△H=-395kJmol-1,故答案为: -395。
O2(g)=SO3(g)△H2=-99kJmol-1;利用盖斯定律将①×3+②×3可得S(s)+3/2O2(g)=SO3(g)△H=-395kJmol-1,故答案为: -395。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案