题目内容
【题目】据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理下图所示,该装置工作时,下列叙述错误的是
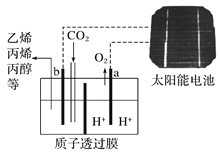
A. b极上生成乙烯的电极反应式为:2CO2+12H++12e-===C2H4+4H2O
B. a接太阳能电池的正极
C. a级上发生还原反应生成标况下22.4 L氧气时,电路中转移的电子数为4NA
D. 溶液中H+通过质子透过膜向b极移动
【答案】C
【解析】
太阳能电池中光能转化为电能,电解强酸性的二氧化碳水溶液得到乙烯,电能转化为化学能;电解时,二氧化碳在b极上得电子发生还原反应生成乙烯,水在a极上失电子发生氧化反应生成氧气,据此回答。
A.电解时,二氧化碳在b极上得电子发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故A正确;
B.a为电解池的阳极,连接的是太阳能电池的正极,故B正确;
C.水在a极上发生氧化反应生成氧气,生成在标况下22.4L即1mol氧气时,电路中转移的电子数为4NA,故C错误;
D.b为阴极,溶液中H+通过质子透过膜向阴极移动,故D正确。
故选C。

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目