题目内容
3.如图是研究氯气性质的装置图,其中气体M的主要成分是氯气,杂质是氯化氢和水蒸气.回答下列问题: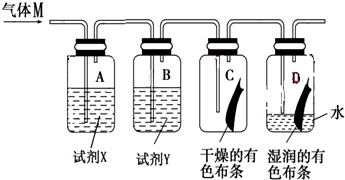
(1)装置A、B中的试剂X和试剂Y分别是b(填字母代号).
a.NaOH溶液 浓硫酸 b.NaCl溶液 浓硫酸 c.浓硫酸 石灰水
(2)若C中有色布条不褪色,D中有色布条褪色.则具有漂白性的物质是次氯酸(填物质名称),该实验证明氯气能与水反应,反应的离子方程式为Cl+H2O=H++Cl-+HClO.
(3)从绿色化学的角度分析,上述实验装置图中存在一处缺陷,改正的方法是加一个尾气处理装置,该尾气处理装置内发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)实验完毕后,将D中的水溶液(呈黄绿色)取出,分别加入两支试管中,进行如下实验
| 实验编号 | 滴加的试剂 | 实验现象 | 证明存在的微粒 (填微粒符号) |
| A | AgNO3 溶液 | a.产生白色沉淀 | b.Cl- |
| B | 紫色石蕊溶液 | c.先变红色后褪色 | d.H+,HClO |
分析 (1)实验室制备氯气中含有水蒸气,氯化氢,要验证氯气、次氯酸的漂白性,应先除去氯化氢,再除去水;
(2)氯气与水反应生成氯化氢和次氯酸,干燥氯气不能使布条褪色,湿润氯气能够使有色布条褪色,说明具有漂白性的不是氯气,而是次氯酸;
(3)氯气有毒,能够与氢氧化钠溶液反应,用氢氧化钠溶液吸收过量氯气;
(4)依据氯气与水反应生成氯化氢和次氯酸,分析氯水中的成分及性质.
解答 解:(1)实验室制备氯气中含有水蒸气,氯化氢,要验证氯气、次氯酸的漂白性,应先除去氯化氢,再除去水,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水吸收氯化氢,浓硫酸具有吸水性,能够干燥氯气;
故选:b;
(2)氯气与水反应生成氯化氢和次氯酸,离子方程式:Cl+H2O=H++Cl-+HClO;干燥氯气不能使布条褪色,湿润氯气能够使有色布条褪色,说明具有漂白性的不是氯气,而是次氯酸;
故答案为:次氯酸;Cl+H2O=H++Cl-+HClO;
(3)氯气有毒,直接排放能够引起空气污染,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,所以可以用氢氧化钠溶液吸收过量的氯气;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气与水反应生成氯化氢和次氯酸,所以氯水中含有氯气、水、次氯酸分子,含有氢离子、氯离子、次氯酸根离子、氢氧根离子,氯离子能够与银离子反应生成白色氯化银沉淀,氯水中含有盐酸显酸性,所以加入石蕊后变红色,又因为含有次氯酸,具有漂白性,所以红色溶液又褪色;
故答案为:
| 实验编号 | 滴加的试剂 | 实验现象 | 证明存在的微粒 (填微粒符号) |
| A | AgNO3 溶液 | a. 产生白色沉淀 | b. Cl- |
| B | 紫色石蕊溶液 | c. 先变红色后褪色 | d. H+,HClO |
点评 本题考查了氯气的性质的检验,熟悉装置作用是解题关键,注意氯水的成分及性质,为高考的频考点.

练习册系列答案
相关题目
17.某温度下,纯水中的c(H+)=2×10-7mol/L,下列说法正确的是( )
| A. | c(OH-)=2×10-7mol/L | B. | c(OH-)=5×10-8mol/L | ||
| C. | 无法确定OH-浓度 | D. | 该温度低于室温 |
14.下列方法可以制得Al(OH)3的是( )
| A. | Al2O3与水共热 | |
| B. | 少量氯化铝溶液滴入氢氧化钠溶液中 | |
| C. | 少量偏铝酸钠溶液滴入硫酸中 | |
| D. | 足量氨水加入氯化铝溶液中 |
15.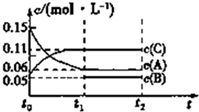 向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.下列说法正确的是( )
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.下列说法正确的是( )
 向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.下列说法正确的是( )
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.下列说法正确的是( )| A. | 该容器的体积为2L | |
| B. | 起始时B的物质的量为0.08mol | |
| C. | 该反应的方程式为3A=2C+B | |
| D. | 若t1=15 s,则用B的浓度变化表示的t0~t1阶段的平均反应速率为0.002 mol/(L•s) |
12.某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )
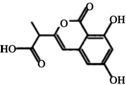

| A. | 1mol该有机物最多可以和4mol Na反应 | |
| B. | 该有机物容易发生加成、取代、中和、消去等反应 | |
| C. | 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物与浓溴水反应,最多消耗3mol Br2 |
13.乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平.结合如图1路线回答:
已知:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
(1)反应II的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(2)D为高分子化合物,可以用来制造多种包装材料,其结构简式是 .
.
(3)E是有香味的物质,在实验室用图2装置制取.
①反应IV的化学方程式是CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
②该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下.
(4)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是3mL和4 mol•L-1.
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.

已知:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
(1)反应II的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(2)D为高分子化合物,可以用来制造多种包装材料,其结构简式是
 .
.(3)E是有香味的物质,在实验室用图2装置制取.
①反应IV的化学方程式是CH3COOH+HOCH2CH3
 CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.②该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下.
(4)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.


