题目内容
14.下列方法可以制得Al(OH)3的是( )| A. | Al2O3与水共热 | |
| B. | 少量氯化铝溶液滴入氢氧化钠溶液中 | |
| C. | 少量偏铝酸钠溶液滴入硫酸中 | |
| D. | 足量氨水加入氯化铝溶液中 |
分析 可溶性铝盐和碱反应生成Al(OH)3,利用弱碱时不需要控制用量,使用强碱时,NaOH不能过量,以此来解答.
解答 解:A.氧化铝和水共热,不反应,故A不选;
B.少量AlCl3溶液滴入NaOH溶液中,反应生成偏铝酸钠和NaCl,故B不选;
C.少量偏铝酸钠溶液滴入硫酸中,反应生成硫酸铝和水,故C不选;
D.因为氢氧化铝不溶于弱碱,属于足量氨水加入氯化铝溶液,生成氢氧化铝沉淀和氯化铵,故D选;
故选D.
点评 本题考查氢氧化铝的制备,把握Al及其化合物的性质为解答的关键,注意氢氧化铝的两性,明确量对反应的影响即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列说法中,正确的是( )
| A. | 分解反应一定是氧化还原反应 | |
| B. | 非金属单质在化学反应中一定是氧化剂 | |
| C. | 金属单质在化学反应中一定是还原剂 | |
| D. | 元素由化合态转化为游离态,该元素一定被还原 |
5.下列各组内的两种物质互为同素异形体的是( )
| A. | 16O和18O | B. | O2和O3 | C. | 乙烷和丙烷 | D. | 乙酸和甲酸甲酯 |
2.过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是( )
| A. | Na2CO3和Na2O2 | B. | 只有Na2CO3 | C. | Na2CO3和NaOH | D. | Na2O和NaHCO3 |
19.实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是( )
| A. | 1000mL,212g | B. | 950mL,201.4g | C. | 任意规格,212g | D. | 500mL,106g |
3.如图是研究氯气性质的装置图,其中气体M的主要成分是氯气,杂质是氯化氢和水蒸气.回答下列问题: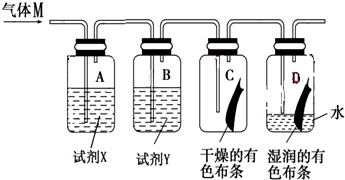
(1)装置A、B中的试剂X和试剂Y分别是b(填字母代号).
a.NaOH溶液 浓硫酸 b.NaCl溶液 浓硫酸 c.浓硫酸 石灰水
(2)若C中有色布条不褪色,D中有色布条褪色.则具有漂白性的物质是次氯酸(填物质名称),该实验证明氯气能与水反应,反应的离子方程式为Cl+H2O=H++Cl-+HClO.
(3)从绿色化学的角度分析,上述实验装置图中存在一处缺陷,改正的方法是加一个尾气处理装置,该尾气处理装置内发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)实验完毕后,将D中的水溶液(呈黄绿色)取出,分别加入两支试管中,进行如下实验

(1)装置A、B中的试剂X和试剂Y分别是b(填字母代号).
a.NaOH溶液 浓硫酸 b.NaCl溶液 浓硫酸 c.浓硫酸 石灰水
(2)若C中有色布条不褪色,D中有色布条褪色.则具有漂白性的物质是次氯酸(填物质名称),该实验证明氯气能与水反应,反应的离子方程式为Cl+H2O=H++Cl-+HClO.
(3)从绿色化学的角度分析,上述实验装置图中存在一处缺陷,改正的方法是加一个尾气处理装置,该尾气处理装置内发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)实验完毕后,将D中的水溶液(呈黄绿色)取出,分别加入两支试管中,进行如下实验
| 实验编号 | 滴加的试剂 | 实验现象 | 证明存在的微粒 (填微粒符号) |
| A | AgNO3 溶液 | a.产生白色沉淀 | b.Cl- |
| B | 紫色石蕊溶液 | c.先变红色后褪色 | d.H+,HClO |
1.甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用如图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验).
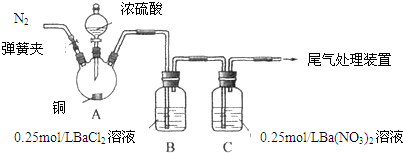
实验操作和现象:
(1)A中反应的化学方程式是Cu+2H2SO4$\stackrel{△}{→}$CuSO4+SO2↑+2H2O.
(2)C中白色沉淀是Ba2SO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2=2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:甲--有大量白色沉淀;乙--有少量白色沉淀检验白色沉淀,发现均不溶于稀盐酸.结合离子方程式解释实验现象异同的原因:甲:SO42-+Ba2+→BaSO4↓,乙:2Ba2++2SO2+O2+2H2O→2BaSO4↓+4H+
白雾的量远多于装置中O2的量.
(5)合并(4)中两同学的方案进行实验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.

实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是Ba2SO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2=2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:甲--有大量白色沉淀;乙--有少量白色沉淀检验白色沉淀,发现均不溶于稀盐酸.结合离子方程式解释实验现象异同的原因:甲:SO42-+Ba2+→BaSO4↓,乙:2Ba2++2SO2+O2+2H2O→2BaSO4↓+4H+
白雾的量远多于装置中O2的量.
(5)合并(4)中两同学的方案进行实验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.