题目内容
17.某温度下,纯水中的c(H+)=2×10-7mol/L,下列说法正确的是( )| A. | c(OH-)=2×10-7mol/L | B. | c(OH-)=5×10-8mol/L | ||
| C. | 无法确定OH-浓度 | D. | 该温度低于室温 |
分析 依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同判断选择即可.
解答 解:某温度下纯水中的C(H+)=2×10-7mol/L,则此时溶液中的C(OH-)=2×10-7mol/L,由于水的电离为吸热反应,故此温度高于室温,故选A.
点评 本题考查了水的离子积概念,溶液中离子积的计算判断,注意离子积常数的应用条件和酸溶液中的计算分析应用,题目较简单.

练习册系列答案
相关题目
7.如图所示,下列叙述正确的是( )
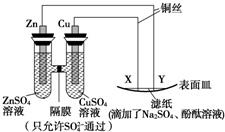

| A. | Y为负极,发生氧化反应 | B. | X为阴极,发生还原反应 | ||
| C. | Y与滤纸接触处变红 | D. | X与滤纸接触处有H2生成 |
5.下列各组内的两种物质互为同素异形体的是( )
| A. | 16O和18O | B. | O2和O3 | C. | 乙烷和丙烷 | D. | 乙酸和甲酸甲酯 |
2.过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是( )
| A. | Na2CO3和Na2O2 | B. | 只有Na2CO3 | C. | Na2CO3和NaOH | D. | Na2O和NaHCO3 |
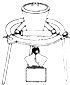
3.如图是研究氯气性质的装置图,其中气体M的主要成分是氯气,杂质是氯化氢和水蒸气.回答下列问题:
(1)装置A、B中的试剂X和试剂Y分别是b(填字母代号).
a.NaOH溶液 浓硫酸 b.NaCl溶液 浓硫酸 c.浓硫酸 石灰水
(2)若C中有色布条不褪色,D中有色布条褪色.则具有漂白性的物质是次氯酸(填物质名称),该实验证明氯气能与水反应,反应的离子方程式为Cl+H2O=H++Cl-+HClO.
(3)从绿色化学的角度分析,上述实验装置图中存在一处缺陷,改正的方法是加一个尾气处理装置,该尾气处理装置内发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)实验完毕后,将D中的水溶液(呈黄绿色)取出,分别加入两支试管中,进行如下实验

(1)装置A、B中的试剂X和试剂Y分别是b(填字母代号).
a.NaOH溶液 浓硫酸 b.NaCl溶液 浓硫酸 c.浓硫酸 石灰水
(2)若C中有色布条不褪色,D中有色布条褪色.则具有漂白性的物质是次氯酸(填物质名称),该实验证明氯气能与水反应,反应的离子方程式为Cl+H2O=H++Cl-+HClO.
(3)从绿色化学的角度分析,上述实验装置图中存在一处缺陷,改正的方法是加一个尾气处理装置,该尾气处理装置内发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)实验完毕后,将D中的水溶液(呈黄绿色)取出,分别加入两支试管中,进行如下实验
| 实验编号 | 滴加的试剂 | 实验现象 | 证明存在的微粒 (填微粒符号) |
| A | AgNO3 溶液 | a.产生白色沉淀 | b.Cl- |
| B | 紫色石蕊溶液 | c.先变红色后褪色 | d.H+,HClO |
4.二氧化硅是酸性氧化物是因为( )
| A. | 硅是非金属 | |
| B. | 它是非金属氧化物 | |
| C. | 二氧化硅能跟氢氧化钠反应生成盐和水 | |
| D. | 它的对应水化物是弱酸,能溶于水 |