题目内容
在热的稀硫酸溶液中溶解11.4g FeSO4。当加入50mL 0.50mol/L KNO3溶液后,使其中的Fe2+全部转化为Fe3+。KNO3溶液也完全反应,并有NxOy气体逸出,此NxOy气体为
| A.N2O | B.N2O3 | C.NO2 | D.NO |
D
解析试题分析:根据题意,11.4g的FeSO4的物质的量是0.075mol,KNO3的物质的量是0.025mol,Fe2+被氧化时失去电子的物质的量是0.075mol,则0.025molKNO3被还原时得到电子的物质的量也是0.075mol,所以,KNO3中的N元素的化合价降低3价,即产物NxOy中N的化合价是+2价,只有NO中N的化合价是+2价,答案选D。
考点:考查氧化还原反应中得失电子守恒规律的应用,产物的判断

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案将1.52 g的铜镁合金完全溶解于50mL14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加人1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.若该浓硝酸的密度为1.40g/mL则该浓硝酸的溶质质量分数为63% |
| B.该合金中铜与镁的物质的最之比是2:1 |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加人NaOH溶液的体积是620 mL |
卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是( )
| A.IF5 + 3H2O = HIO3 +5HF |
| B.3IBr +2Fe = FeI3 + FeBr3 |
| C.BrCl的氧化性强于I2 |
| D.IBr可以与NaOH溶液反应生成2种盐 |
在某100mL混合酸中,HNO3物质的量浓度为0.4mol.L-1,H2SO4物质的量浓度为0.2mol.L-1。向其中加入足量的铜粉,待充分反应后,溶液中Cu2+物质的量浓度为
| A.0.3mol.L-1 | B.0.225mol.L-1 | C.0.15mol.L-1 | D.无法计算 |
双氧水可作为采矿业废液的处理剂,如用来消除采矿废液中的氰化物,反应方程式如下:KCN +H2O2+H2O===A+NH3↑。下列说法正确的是
| A.生成物A是一种正盐 | B.氨气是还原产物 |
| C.该反应中H2O2作氧化剂 | D.处理1 mol KCN转移1 mol电子 |
下表中对应关系正确的是
| A | CH3CH3+Cl2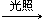 CH3CH2Cl+HCl CH3CH2Cl+HClCH2=CH2+HCl  CH3CH2Cl CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br?=2Cl?+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O+4NaOH+O2↑ Cl2+H2O="HCl+HClO" | 均为水作还原剂的氧化还原反应 |
下列进行性质比较的实验,不合理的是
| A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中 |
| B.比较氯的非金属性强于溴:溴化钠溶液中通入氯气 |
| C.比较高锰酸钾的氧化性强于氯气:高锰酸钾中加入浓盐酸 |
| D.比较镁的金属性强于铝:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol·L-1的盐酸中 |
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2 =" d" Fe3++ e Br2+ f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A.2 4 3 2 2 6 | B.0 2 1 0 1 2 |
| C.2 0 1 2 0 2 | D.2 2 2 2 1 4 |
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是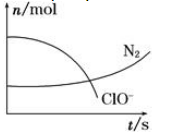
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO- , 还原产物是HCO3- |
| C.配平后氧化剂与还原剂的化学计量数之比为5∶2 |
| D.若生成2.24 L N2(标准状况),则转移电子0.5 mol |