题目内容
将1.52 g的铜镁合金完全溶解于50mL14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加人1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.若该浓硝酸的密度为1.40g/mL则该浓硝酸的溶质质量分数为63% |
| B.该合金中铜与镁的物质的最之比是2:1 |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加人NaOH溶液的体积是620 mL |
D
解析
试题分析: 反应后溶质为硝酸钠,据氮元素守恒可知,硝酸钠的物质的量为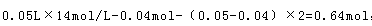 ,据钠离子守恒可知
,据钠离子守恒可知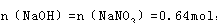 故需要氢氧化钠溶液体积为
故需要氢氧化钠溶液体积为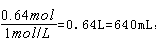 所以D选项错误。
所以D选项错误。
考点:考查混合物的相关计算

练习册系列答案
相关题目
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”, S2O32-与Cl2反应的产物之一为SO42一。下列说法中,错误的是 ( )
| A.该反应中的氧化剂是C12 |
| B.SO2与氯水的漂白原理相同,所以可用S02做纺织工业的漂白剂 |
| C.上述反应中,每生成1 mol SO42一,可脱去2 mol C12 |
| D.根据该反应可判断还原性:S2O32->C1— |
已知反应KClO3+6HCl = KCl+3Cl2↑+3 H2O,下列判断正确的是
| A.KClO3被氧化 |
| B.氧化剂与还原剂之比为1:6 |
| C.氧化产物是Cl2 |
| D.HCl在化学反应中只能作还原剂 |
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
| A.无水硫酸铜、蔗糖 | B.硅胶、硫酸亚铁 |
| C.食盐、硫酸亚铁 | D.生石灰、食盐 |
宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2="==2" Ag2S +2H2O,其中H2S是
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |


