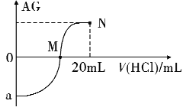
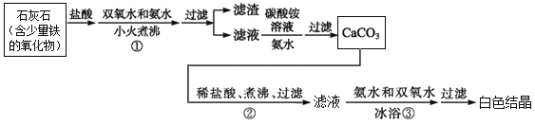
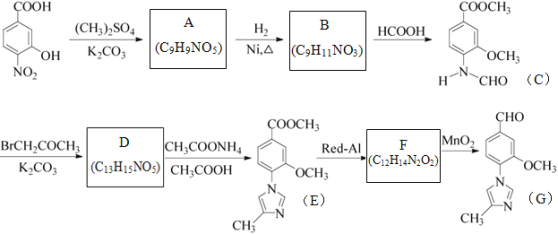
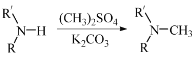
题目内容
【题目】X、Y、Z、W 为四种常见元素,其中 X、Y、Z 为短周期元素。ZX4分子是由粗Z提纯Z的中间产物,X的最高价氧化物对应的水化物为无机酸中的最强酸,Y的离子在同周期中离子半径最小,其氧化物有两性且可用于制造一种极有前途的高温材料,Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,W原子的最外层电子数小于4且W的常见化合价有+3、+2,WX3 的稀溶液呈黄色,回答下列问题:
(1)X在元素周期表的位置________________,其简单阴离子的结构示意图为____________________,用电子式表示X的氢化物的形成过程______________________________。
(2)Z的氧化物在通讯领域用来作_______________。锗与Z是同一主族元素,它可用来制造半导体晶体管。研究表明:有机锗具有明显的抗肿瘤活性,锗不与 NaOH溶液反应但在有 H2O2 存在时可与NaOH溶液反应生成锗酸盐,反应的化学方程式为:_______________________________
(3)W(OH)2 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为:____________________________________,若灼烧W(OH)2 固体得到___________。
【答案】第三周期ⅦA族 
![]() 光导纤维 Ge + 2H2O2 + 2NaOH = Na2GeO3 + 3H2O 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 Fe2O3
光导纤维 Ge + 2H2O2 + 2NaOH = Na2GeO3 + 3H2O 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 Fe2O3
【解析】
根据元素的性质及用途等信息分析元素的种类;根据核外电子排布情况确定在元素周期表中的位置;根据物质的性质及反应的现象书写反应方程式,及用相关化学用语表示物质的组成和结构。
Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,则Z为硅;ZX4分子是由粗Z提纯Z的中间产物,X的最高价氧化物对应的水化物为无机酸中的最强酸,则X为氯;Y的离子在同周期中离子半径最小,其氧化物有两性且可用于制造一种极有前途的高温材料,则Y为铝;W原子的最外层电子数小于4且W的常见化合价有+3、+2,WX3 的稀溶液呈黄色,则W为铁;
(1)X为氯元素,在元素周期表的位置为:第三周期ⅦA族;氯离子的结构示意图为: ;用电子式表示HCl的形成过程:
;用电子式表示HCl的形成过程:![]() ;
;
(2)Z为硅,二氧化硅在通讯领域用作光导纤维;根据题干信息知锗NaOH溶液在有H2O2 存在时反应生成锗酸盐,反应的化学方程式为:Ge + 2H2O2 + 2NaOH = Na2GeO3 + 3H2O;
(3)反应现象知该反应为氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 ,Fe(OH)3不稳定,灼烧分解得到固体Fe2O3。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案