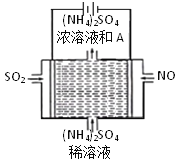
题目内容
【题目】砷(As)原子序数为33,可以形成As2S3、As2O5、H3ASO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)砷在周期表中的位置为第___周期___族。
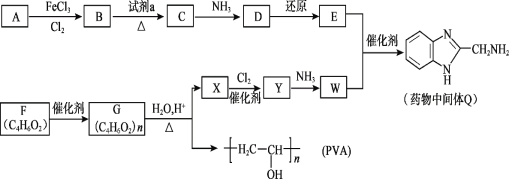
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。若反应生成6mol单质硫,则需要___molO2。该反应需要在加压下进行,原因是___。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3ASO4(s) △H1
H2(g)+2O2(g)=H3ASO4(s) △H1
H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
2As(s)+![]() O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3
则反应2H3AsO4(s)=As2O5(s)+3H2O(l)的△H=___。
(4)298K时,将10mL3xmol·L-1Na3AsO3、10mL3xmol·L-1I2和10mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)=AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
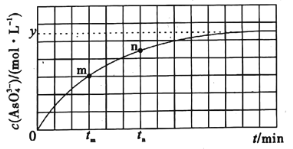
①下列可判断反应达到平衡的是___(填标号)。
a.v(OH-)=2v(AsO33-)
b.I2的浓度不再变化
c.![]() 不再变化
不再变化
d.c(I-)=ymol·L-1
②tm时,v正___v逆(填“大于”“小于”或“等于”)。
③图中m点和n点的逆反应速率较大的是___。
④若平衡时溶液的c(H+)=10-14mol/L,则该反应的平衡常数K为___。
【答案】四 ⅤA 5 提高氧气浓度,有效提高As2S3转化率 3△H2+△H3-2△H1 bc 大于 n 
【解析】
(1)砷是33号元素,有4个电子层,最外层有5个电子;
(2)As2S3生成H3AsO4和单质硫,1 molAs2S3生成3molS,化合价总升高10;增大压强可以提高氧气浓度;
(3)根据盖斯定律计算2H3AsO4(s)=As2O5(s)+3H2O(l)的焓变;
(4)①根据平衡标志分析;
②tm时刻后,c(AsO43-)增大;
③c(AsO43-)越大,逆反应速率越大;
④利用“三段式”计算平衡常数;
(1)砷是33号元素,有4个电子层,最外层有5个电子,所以砷在周期表的第四周期第ⅤA族;
(2)As2S3生成H3AsO4和单质硫,1molAs2S3生成3molS,化合价总升高10;若生成6molS需要2mol As2S3,转移20mol电子,根据得失电子守恒消耗5mol氧气;增大压强可以提高氧气浓度,有效提高As2S3转化率;
(3)已知:① As(s)+![]() H2(g)+2O2(g)=H3ASO4(s) △H1
H2(g)+2O2(g)=H3ASO4(s) △H1
② H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
③ 2As(s)+![]() O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3
根据盖斯定律②×3+③-①×2得2H3AsO4(s)=As2O5(s)+3H2O(l) △H=3△H2+△H3-2△H1。
(4)①a.v(OH-)=2v(AsO33-),不能判断正逆反应速率是否相等,不一定平衡,故不选a;
b.化学平衡状态是各物质浓度不变的状态,I2的浓度不再变化,一定平衡,故选b;
c. OH-是反应物,AsO43-是生成物,![]() 不再变化,说明浓度不变,一定平衡,故不选c;
不再变化,说明浓度不变,一定平衡,故不选c;
d.根据图象可知,平衡时c(I-)=2c(AsO43-)=2 ymol·L-1, 所以c(I-)=ymol·L-1时,该反应一定不平衡,故不选d;选bc。
②tm时刻后,c(AsO43-)增大,反应正向进行,v正大于v逆;
③c(AsO43-)越大,逆反应速率越大;图中n点c(AsO43-)大于m点,所以逆反应速率较大的是n;
④将10mL3xmol·L-1Na3AsO3、10mL3xmol·L-1I2和10mLNaOH溶液混合,混合后c(AsO33-)、c(I2)均为xmol·L-1;


 。
。