题目内容
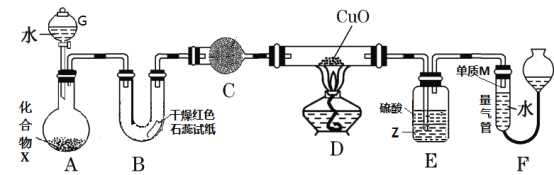
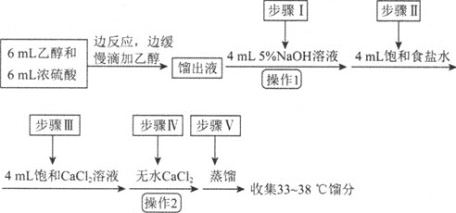
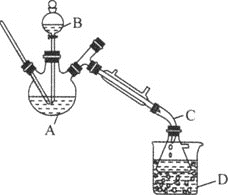
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图![]() 夹持和加热装置已略去
夹持和加热装置已略去![]() 、有关数据和实验步骤如下:
、有关数据和实验步骤如下:
物质 | 相对分子质量 | 密度 | 沸点 | 在水中的溶解性 |
乙醇 | 46 |
| 78 | 互溶 |
乙醚 | 74 |
|
| 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物![]() 。
。
请回答下列问题:
(1)仪器C的名称为_____。
(2)由乙醇制备乙醚的总反应为![]() ,此反应分两步进行,第一步反应的化学方程式为
,此反应分两步进行,第一步反应的化学方程式为![]() ,则第二步反应的化学方程式为_______。
,则第二步反应的化学方程式为_______。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是___。
(4)仪器D中盛有冰水混合物,其作用为___。
(5)操作1的名称为____,操作2的名称为___。
(6)若省略步骤Ⅱ会导致的后果是_______。
(7)若实验过程中共加入18mL乙醇,最终得到8.7g乙醚,则乙醚的产率为______![]() 计算结果精确到
计算结果精确到![]() 。
。
【答案】牛角管(或尾接管) ![]() 防止滴入的乙醇受热被蒸发,提高产物的产率,减少杂质 使乙醚冷凝为液体以便收集 分液 过滤 用饱和氯化钙溶液洗涤乙醚粗品时,析出氢氧化钙沉淀 73.6%
防止滴入的乙醇受热被蒸发,提高产物的产率,减少杂质 使乙醚冷凝为液体以便收集 分液 过滤 用饱和氯化钙溶液洗涤乙醚粗品时,析出氢氧化钙沉淀 73.6%
【解析】
考查有机物的制备,装置A为制备装置,装置D为收集装置,然后按照题中所给信息完成分析;
本实验的目的是制备乙醚,实验原理是2CH3CH2OH![]() CH3CH2OCH2CH3+H2O,
CH3CH2OCH2CH3+H2O,
(1)根据仪器C的特点,仪器C为牛角管或尾接管;
(2)总反应是第一步和第二步的和,即第二步反应的化学方程式为CH3CH2OSO2OH+CH3CH2OH![]() H2SO4+CH3CH2OCH2CH3;
H2SO4+CH3CH2OCH2CH3;
(3)乙醇受热易挥发,该反应加热,造成滴入的乙醇挥发,浪费原料,因此末端浸入反应液可以防止滴入的乙醇受热被蒸发,可以提高乙醇的利用率,提高产物的产率,减少杂质;
(4)依据表格中的数据,乙醚的沸点是34.6℃,从三颈烧瓶中出来的是乙醚气体,因此仪器D中盛有冰水混合物,可以使乙醚气体转变为液体,便于收集;
(5)蒸出的乙醚中混有乙醇,乙醇溶于水,乙醚不溶于水,操作1出现分层,采用分液方法进行分离,得到粗乙醚;操作2加入无水氯化钙,因此操作2应是过滤;
(6)乙醚在饱和食盐水比在水中更难溶,加入饱和食盐水,目的是除去过量的NaOH溶液,缺少该步骤,加入饱和CaCl2溶液,CaCl2与过量的NaOH反应生成Ca(OH)2沉淀,不利于产品的分离;
(7)18mL乙醇的物质的量为18mL×0.816g·mL-1÷46g·mol-1≈0.319mol,根据生成乙醚的反应方程式,得出乙醚的物质的量为0.319mol/2=0.1595mol,其质量为0.1595mol×74g·mol-1=11.803g,产率为8.7g÷11.803g×100%≈73.6%。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A. T1时0~10 min NO2的平均反应速率为0.15 mol·L-1·min -1
B. T2时CH4的平衡转化率为70.0%
C. 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大
【题目】如下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的元素符号是________(填写元素符号)。
(2)表中金属性最强的元素是____(填元素符号),该元素在周期表中的位置是_______。
(3)写出①、③、④最高价氧化物对应的水化物两两反应的化学方程式
_________________________________
_________________________________
_________________________________
(4)请设计一个实验方案,比较⑦、⑧非金属性的强弱(用化学方程式表示):_______。
(5)③、⑦两种元素形成的化合物的电子式为_____,⑦的气态氢化物的电子式为_______。