题目内容
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
)。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
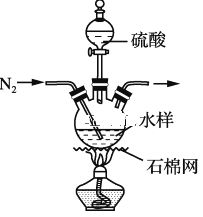
步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置如图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100mL 0.206 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500mL溶液。量取25.00mL溶液于锥形瓶中,加入几滴酚酞试剂,并滴加0.05mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O 恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是____。
(2)用H2C2O4溶液滴定至终点时,溶液颜色变化是____。
(3)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____
【答案】 将水样中的CO32-和HCO3- 转化为CO2,并将CO2完全赶出 溶液由浅红色变为无色且30s内不变色 144 mg·L-1
【解析】(1)碳酸盐与稀硫酸反应生成二氧化碳;(2)滴定前是滴加酚酞的氢氧化钡溶液,溶液为红色,用H2C2O4溶液滴定至终点时,溶液颜色变化是溶液由浅红色变为无色且30s内不变色;(3)n(H2C2O4)=0.05000mol/L×20.00×10-3L=1.000×10-3mol,与H2C2O4反应的Ba(OH)2的物质的量:n1[Ba(OH)2]= n(H2C2O4)= 1.000×10-3mol。与CO2反应的Ba(OH)2的物质的量:n2[Ba(OH)2]=0.206mol/L×0.1L-1.000×10-3mol×![]() =6.000×10-4mol。由水样中有机物转化成CO2的物质的量:n(CO2)= n2[Ba(OH)2]= 6.000×10-4mol。水样中有机物含碳元素的物质的量:n(C)= n(CO2) = 6.000×10-4mol,以此计算。
=6.000×10-4mol。由水样中有机物转化成CO2的物质的量:n(CO2)= n2[Ba(OH)2]= 6.000×10-4mol。水样中有机物含碳元素的物质的量:n(C)= n(CO2) = 6.000×10-4mol,以此计算。
(1)碳酸盐与稀硫酸反应生成二氧化碳,则步骤1的目的是将水样中的CO32-和HCO3-转化为CO2,并将CO2完全赶出。
(2)滴定前是滴加酚酞的氢氧化钡溶液,溶液为红色,用H2C2O4溶液滴定至终点时,溶液颜色变化是溶液由浅红色变为无色且30s内不变色;
(3)n(H2C2O4)=0.05000mol/L×20.00×10-3L=1.000×10-3mol,与H2C2O4反应的Ba(OH)2的物质的量:n1[Ba(OH)2]= n(H2C2O4)= 1.000×10-3mol。
与CO2反应的Ba(OH)2的物质的量:n2[Ba(OH)2]=0.206mol/L×0.1L-1.000×10-3mol×![]() =6.000×10-4mol。
=6.000×10-4mol。
由水样中有机物转化成CO2的物质的量:n(CO2)= n2[Ba(OH)2]= 6.000×10-4mol。
水样中有机物含碳元素的物质的量:n(C)= n(CO2) = 6.000×10-4mol,
水样中总有机碳:![]() =144 mg·L-1。
=144 mg·L-1。

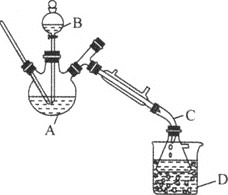
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图![]() 夹持和加热装置已略去
夹持和加热装置已略去![]() 、有关数据和实验步骤如下:
、有关数据和实验步骤如下:

物质 | 相对分子质量 | 密度 | 沸点 | 在水中的溶解性 |
乙醇 | 46 |
| 78 | 互溶 |
乙醚 | 74 |
|
| 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物![]() 。
。
请回答下列问题:
(1)仪器C的名称为_____。
(2)由乙醇制备乙醚的总反应为![]() ,此反应分两步进行,第一步反应的化学方程式为
,此反应分两步进行,第一步反应的化学方程式为![]() ,则第二步反应的化学方程式为_______。
,则第二步反应的化学方程式为_______。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是___。
(4)仪器D中盛有冰水混合物,其作用为___。
(5)操作1的名称为____,操作2的名称为___。
(6)若省略步骤Ⅱ会导致的后果是_______。
(7)若实验过程中共加入18mL乙醇,最终得到8.7g乙醚,则乙醚的产率为______![]() 计算结果精确到
计算结果精确到![]() 。
。