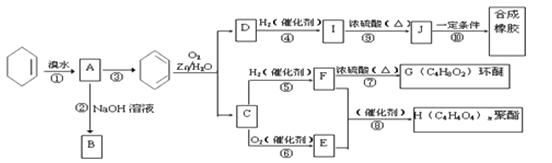
题目内容
【题目】如下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的元素符号是________(填写元素符号)。
(2)表中金属性最强的元素是____(填元素符号),该元素在周期表中的位置是_______。
(3)写出①、③、④最高价氧化物对应的水化物两两反应的化学方程式
_________________________________
_________________________________
_________________________________
(4)请设计一个实验方案,比较⑦、⑧非金属性的强弱(用化学方程式表示):_______。
(5)③、⑦两种元素形成的化合物的电子式为_____,⑦的气态氢化物的电子式为_______。
【答案】Cl Na 第3周期IA族 Al(OH)3+3HNO3===Al(NO3)3+3H2O Al(OH)3+NaOH===Na[Al(OH)4] HNO3+NaOH=NaNO3+H2O Na2S+Cl2=2NaCl+S↓ ![]()
![]()
【解析】
由元素在周期表中位置,可知①为N元素、②为F元素、③为Na元素、④为Al元素、⑤为Si元素、⑥为P元素、⑦为S元素、⑧为Cl元素。
(1)⑧为Cl元素,故答案为:Cl;
(2)表中元素金属性最强的是位于周期表左下角的Na元素,Na元素位于周期表第3周期IA族,故答案为:Na;第3周期IA族;
(3)①、③、④最高价氧化物对应的水化物的分子式为强酸HNO3、两性氢氧化物Al(OH)3、强碱NaOH,两性氢氧化物Al(OH)3既能强酸反应也能与强碱反应,反应的化学方程式为Al(OH)3+3HNO3=Al(NO3)3+3H2O,Al(OH)3+NaOH=Na[Al(OH)4],强酸HNO3和强碱NaOH能够发生中和反应,反应的化学方程式为HNO3+NaOH=NaNO3+H2O,故答案为:Al(OH)3+3HNO3=Al(NO3)3+3H2O,Al(OH)3+NaOH=Na[Al(OH)4],HNO3+NaOH=NaNO3+H2O;
(4)⑦为S元素,⑧为Cl元素,同周期元素从左向右元素的非金属增强,则Cl的非金属性强,可利用氯气和硫化钠溶液或氢硫酸溶液发生置换反应生成硫单质证明氯元素的非金属性比硫元素强,反应的化学方程式为Na2S+Cl2=2NaCl+S↓,故答案为:Na2S+Cl2=2NaCl+S↓;
(5)③为Na元素,⑦为S元素,两种元素形成的化合物为离子化合物硫化钠,电子式为:![]() ;S元素的氢化物是共价化合物硫化氢,电子式为:
;S元素的氢化物是共价化合物硫化氢,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。

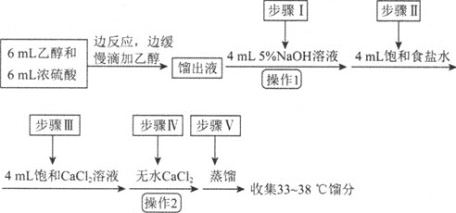
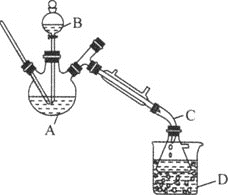
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图![]() 夹持和加热装置已略去
夹持和加热装置已略去![]() 、有关数据和实验步骤如下:
、有关数据和实验步骤如下:
物质 | 相对分子质量 | 密度 | 沸点 | 在水中的溶解性 |
乙醇 | 46 |
| 78 | 互溶 |
乙醚 | 74 |
|
| 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物![]() 。
。
请回答下列问题:
(1)仪器C的名称为_____。
(2)由乙醇制备乙醚的总反应为![]() ,此反应分两步进行,第一步反应的化学方程式为
,此反应分两步进行,第一步反应的化学方程式为![]() ,则第二步反应的化学方程式为_______。
,则第二步反应的化学方程式为_______。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是___。
(4)仪器D中盛有冰水混合物,其作用为___。
(5)操作1的名称为____,操作2的名称为___。
(6)若省略步骤Ⅱ会导致的后果是_______。
(7)若实验过程中共加入18mL乙醇,最终得到8.7g乙醚,则乙醚的产率为______![]() 计算结果精确到
计算结果精确到![]() 。
。