题目内容
5.已知某“84消毒液”瓶体部分标签如下所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:84消毒液
【有效成分】NaClO
【规格】1000mL
【质量分数】37.25%
【密度】1.2g•cm-3
(1)该“84消毒液”的物质的量浓度约为6.0mol•L-1(小数点后保留一位).
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=0.06 mol•L-1.
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为37.25%的消毒液.下列说法正确的是C(填序号).

A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为214.6g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g•cm-3)的浓硫酸配制1000mL 2.3mol•L-1的稀硫酸用于增强“84消毒液”的消毒能力.
①所配制的稀硫酸中,H+的物质的量浓度为4.6mol•L-1.
②需用浓硫酸的体积为125.0mL.
分析 (1)依据C=$\frac{1000ρω}{M}$计算84消毒液的物质的量浓度;
(2)依据溶液稀释过程中钠离子物质的量不变计算;
(3)根据溶液的配制及c=$\frac{n}{V}$、m=nM来分析;
(4)①根据c(H2SO4)=$\frac{1}{2}$c(H+)计算;
②根据溶液稀释前后溶质的物质的量不变计算.
解答 解:(1)37.25%密度为1.2g•cm-3的消毒液中次氯酸钠的物质的量浓度C=$\frac{1000×1.2×37.25%}{74.5}$=6.0mol/L;
故答案为:6.0;
(2)6.0mol/L的次氯酸钠溶液中钠离子浓度为6.0mol/L,某同学取100mL该“84消毒液”,稀释100倍钠离子浓度为6.0mol/L×10-2=0.06mol/L;
故答案为:0.06;
(3)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、不需要,但还需玻璃棒和胶头滴管,故A错误;
B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,可能导致结果偏低,故C正确;
D.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×6.0 mol•L-1×74.5 g•mol-1=223.5g,故D错误;
故选:C;
(4)①c(H2SO4)=2.3mol•L-1,则c(H+)=4.6mol•L-1,
故答案为:4.6;
②溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=$\frac{1000×1.84×98%}{98}$=18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=1L×2.3mol/L,V=0.25L=125.OmL,
故答案为:125.0.
点评 本题考查物质的量浓度的计算以及溶液的配制,明确配制原理是解题关键,注意误差分析的方法,题目难度不大.

| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol | |
| D. | CO(g)+O2(g)═CO2(g)△H=-258 kJ/mol |
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
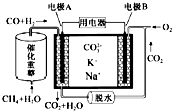
| A. | 反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1mol CH4转移12mol电子 | |
| B. | 电池工作时,CO32-向电极B移动 | |
| C. | 电极B上发生的电极反应为O2+2CO2+4e-═2CO32- | |
| D. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O |
| A. | 元素处于最高价态时一定有强氧化性 | |
| B. | 含氧酸的价态越高,氧化性一定越强 | |
| C. | 金属元素被还原,不一定得到金属单质 | |
| D. | 氧化还原反应的本质是元素化合价的升降 |
| A. | 溶液中c(Ca2+)将增大 | B. | 溶液的pH将增大 | ||
| C. | 溶液中Ca2+总数将减少 | D. | 溶液中c(OH-)减小 |
| A. | 溴水中:Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 反应:CO+NO2?CO2+NO(△H<0),达平衡后,提高温度体系颜色变深 | |
| C. | 对于反应:2HI(g)?H2(g)+I2(g)达平衡后,缩小体积可使体系颜色变深 | |
| D. | 合成氨反应,为提高氨的产率,采取高压的措施 |
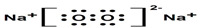
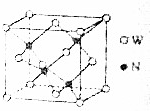 X、Y、Z、W、N是原子序数依次增大的前四周期元素,其中X的s能级电子数是p能级电子数的2倍,Y的原子核外有3个未成对电子,Z的基态原子M层与K层电子数相等,Y与Z的最外层电子数之和等于W的最外层电子数,N+原子核外有3个电子层且各层均处于全满状态.回答下列问题:
X、Y、Z、W、N是原子序数依次增大的前四周期元素,其中X的s能级电子数是p能级电子数的2倍,Y的原子核外有3个未成对电子,Z的基态原子M层与K层电子数相等,Y与Z的最外层电子数之和等于W的最外层电子数,N+原子核外有3个电子层且各层均处于全满状态.回答下列问题: