题目内容
20.实验室里用乙醇和浓硫酸反应生成乙烯,接着再用溴与之反应生成1,2-二溴乙烷.在制备过程中由于部分乙醇被浓硫酸氧化还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体.(1)用下列仪器,以上述三种物质为原料制备1,2-二溴乙烷.如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):
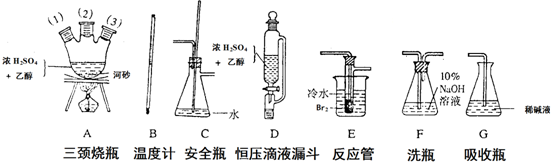
B经A(1)插入A中,D接A(2);A(3)接C,C接F接E接G.
(2)在三颈烧瓶A中的主要反应的化学方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(3)在反应管E中进行的主要反应的化学方程式为CH2═CH2+Br2→BrCH2CH2Br;
(4)温度计水银球的正确位置是应插入至液面以下;
(5)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为溴易挥发,这样做可以减少溴的挥发损失.
分析 (1)制取乙烯气体(用A、B、D组装)一安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G)”;
(2)乙醇在浓硫酸作用下加热到1700C时发消去反应生成乙烯,据此写出反应的方程式;
(3)在反应管E中进行的主要反应为乙烯和溴的加成反应,乙烯与溴单质反应生成1,2-二溴乙烷,据此写出反应的方程式;
(4)温度计需要测量混合液温度,则温度计的位置应插入三颈烧瓶的液体中;
(5)溴易挥发,为减少挥发,在反应管E中加入少量水并把反应管E置于盛有冷水的小烧杯中,可降低温度、减少溴的挥发.
解答 解:(1)仪器组装顺序是:制取乙烯气体(用A、B、D组装)一安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G)”,B经A(1)插入A中,D接A(2);A(3)接C,C接F接E接G,
故答案为:B;D;F;E;
(2)乙醇在浓硫酸作用下加热到1700C时发消去反应生成乙烯,反应的方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(3)在反应管E中进行的主要反应为乙烯和溴的加成反应,反应的方程式为CH2═CH2+Br2→BrCH2CH2Br,
故答案为:CH2═CH2+Br2→BrCH2CH2Br;
(4)乙醇在浓硫酸作用下加热到1700C时发消去反应生成乙烯,则温度计的位置应插入三颈烧瓶的液体中,
故答案为:应插入至液面以下;
(5)溴易挥发,为减少挥发,在反应管E中加入少量水可起到水封的作用,把反应管E置于盛有冷水的小烧杯中,可降低温度,减少挥发,
故答案为:溴易挥发,这样做可以减少溴的挥发损失.
点评 本题考查乙烯的制取及性质检验,题目难度中等,解答本题的关键是把握制备实验的原理,能正确设计实验顺序,牢固把握实验基本操作时解答该类题目的保证,学习中注意加强相关知识的全面学习.

| A. | 乙炔的最简式:CHCH | B. | 甲基苯的官能团为: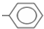 | ||
| C. | 丙烷分子的球棍模型示意图: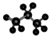 | D. | -CH3(甲基)的电子式为: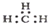 |
| A. | 6个碳原子都在一条直线上 | B. | 有可能5个碳原子在一条直线上 | ||
| C. | 6个碳原子都在同一平面上 | D. | 6个碳原子不可能在同一平面上 |
| A. |
| B. |
| C. |
| D. |
|
| A. | 非金属性比硫强 | B. | 原子序数为34 | ||
| C. | 氢化物比HBr稳定 | D. | 最高价氧化物的水化物显碱性 |
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$;
(2)该反应为吸热反应(填“吸热”或“放热”.)
(3)能判断该反应达到化学平衡状态的是bc(填字母).
a.容器中总压强不变
b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等
d.c(CO2)=c(CO)
 为了验证铜与稀硝酸反应产生的是一氧化氮而不是氢气.某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;C中有足量的澄清石灰水,E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了验证铜与稀硝酸反应产生的是一氧化氮而不是氢气.某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;C中有足量的澄清石灰水,E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.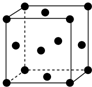 (1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.
(1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.