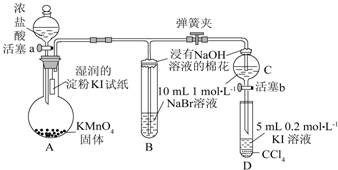
题目内容
1.下列说法不正确的是( )| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol. CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol. C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol. 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=$\frac{{{{(cα)}^2}}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 |
分析 A.冰是由水分子通过氢键形成的分子晶体,冰的熔化热为6.0kJ•mol-1,1mol冰变成0℃的液态水所需吸收的热量为6.0kJ,全用于打破冰的氢键,冰中氢键键能为20.0kJ•mol-1,1mol冰中含有2mol氢键,需吸收20×2=40.0kJ的热量,据此计算;
B.选项中涉及热化学方程式问题.热化学方程式是表示化学反应中的物质变化和能量变化的方程式.△H为“-”为放热反应,△H为“+”为吸热反应.热化学方程式中化学计量数只表示该物质的物质的量,不表示物质分子个数或原子个数,它可以是整数,也可以是分数;C.选项中涉及标准燃烧热问题.标准燃烧热是指:在标态及TK条件下,1mol物质的量物质完全燃烧时的反应热;
D.选项中涉及电离度问题.电离度与弱电解质的电离程度有关.不同的弱电解质电离的程度不同,电离度是指:弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数;
解答 解:A.冰是由水分子通过氢键形成的分子晶体,冰的熔化热为6.0kJ•mol-1,1mol冰变成0℃的液态水所需吸收的热量为6.0kJ,全用于打破冰的氢键,冰中氢键键能为20.0kJ•mol-1,1mol冰中含有2mol氢键,需吸收40.0kJ的热量,$\frac{6.0kJ}{40.0kJ}$×100%=15%.由计算可知,最多只能打破1mol冰中全部氢键的15%,故A正确;
B.Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g);△H=+489.0 kJ•mol-1…①
CO(g)+12O2(g)═CO2(g);△H=-283.0 kJ•mol-1…②
C(石墨)+O2(g)═CO2(g);△H=-393.5 kJ•mol-1…③
4Fe(s)+3O2(g)═2Fe2O3(s);△H=-1641.0 kJ•mol-1…④
根据盖斯定律,方程式4Fe(s)+3O2(g)═2Fe2O3(s)可由[(③-②)×6]-(①×2)可得,
△H=[-393.5 kJ•mol-1-(-283.0 kJ•mol-1)]×6-(489.0 kJ•mol-1×2)=-1641.0 kJ•mol-1,故B正确;
C.实验测得环己烷(l)和环己烯(l)的标准燃烧热分别为-3916kJ•mol-1和-3747kJ•mol-1,1mol环己烯(l)与环己烷(l)相比,形成1mol碳碳双键,能量降低169kJ,假如苯分子中有独立的碳碳双键,苯(l)与环己烷(l)相比,形成三个碳碳双键,则能量应降低169kJ•mol-1×3=507kJ/mol,而实际测得苯的燃烧热仅为3265 kJ•mol-1,能量降低了3916 kJ•mol-1-3265 kJ•mol-1=691kJ•mol-1,远大于507kJ•mol-1,充分说明苯分子不是环己三烯的结构,可以证明在苯分子中不存在独立的碳碳双键,故C正确;
D.Ka是电离常数,是弱电解质达电离平衡时的平衡常数,在一定温度下,与浓度无关.Ka的计算用溶液中电离出来的各离子浓度乘积与溶液中未电离的电解质分子浓度的比值,一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,CH3COOH?CH3COO-+H+醋酸电离出的CH3COO-和H+浓度均为cα,溶液中未电离的电解质分子浓度为c(1-α),故题中Ka=$\frac{(cα){\;}^{2}}{c(1-α)}$.若加入少量醋酸钠固体,CH3COONa═CH3COO-+Na+增大了CH3COO-的浓度,CH3COOH?CH3COO-+H+向左移动,α减小,但醋酸的浓度比原先的大,分子分母中c变大,Ka不变,故D错误;
故选D.
点评 本题是一道侧重考查化学基本理论知识的综合题,涉及氢键、电离平衡、盖斯定律等知识.做题时要正确理解这些概念的内涵.会运用盖斯定律进行计算;

 快乐5加2金卷系列答案
快乐5加2金卷系列答案| A. | 非金属性比硫强 | B. | 原子序数为34 | ||
| C. | 氢化物比HBr稳定 | D. | 最高价氧化物的水化物显碱性 |
 ,以下叙述错误的是( )
,以下叙述错误的是( )| A. | A属于醛类 | |
| B. | A有相对分子质量为58 | |
| C. | A分子中有6个原子含C 40% | |
| D. | 1molA与足量银氨溶液反应还原出4molAg |
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$;
(2)该反应为吸热反应(填“吸热”或“放热”.)
(3)能判断该反应达到化学平衡状态的是bc(填字母).
a.容器中总压强不变
b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等
d.c(CO2)=c(CO)
| A. | 2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l),△H2 | |
| B. | S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g),△H1; C(s)+O2(g)=CO2(g),△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2 |
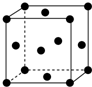 (1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.
(1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4. .
.