题目内容
12.在CaCO3(Ksp=4.9×10-9mol2•L-2)、CaF2(Ksp=1.5×10-10mol3•L-3)、Ca3(PO4)2(Ksp=2.1×10-33mol5•L-5)这些物质的饱和溶液中,Ca2+浓度由大到小的顺序为CaF2>CaCO3>Ca3(PO4)2.分析 根据CaCO3的Ksp=c(Ca2+)•c(CO32-),CaF2 的Ksp=c(Ca2+)•c2(F-),Ca3(PO4)2的Ksp=c3(Ca2+)•c2(PO43-),分别求出Ca2+的浓度大小进行比较.
解答 解:饱和溶液中,CaCO3的Ksp=c(Ca2+)•c(CO32-)=4.9×10-9mol2•L-2,c(Ca2+)=$\root{2}{4.9×1{0}^{-9}}$mol/L,
CaF2 的Ksp=c(Ca2+)•c2(F-)═1.5×10-10mol3•L-3,c(Ca2+)=$\root{3}{1.5×1{0}^{-10}}$mol/L,
Ca3(PO4)2的Ksp=c3(Ca2+)•c2(PO43-)=2.1×10-33mol5•L-5,c(Ca2+)=$\root{5}{2.1×1{0}^{-33}}$mol/L,
所以这些物质的饱和溶液中,Ca2+浓度由大到小的顺序为CaF2>CaCO3>Ca3(PO4)2,
故答案为:CaF2>CaCO3>Ca3(PO4)2.
点评 本题考查了Ksp的计算,正确进行各沉淀物的Ksp表达式的书写是解答关键,题目难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
20.在pH=a的某电解质溶液中插入两支惰性电极,电解一段时间后,溶液pH<a,则电解质是( )
| A. | Na2SO4 | B. | KCl | C. | NaOH | D. | CuSO4 |
7.在1 000K时,已知反应Ni(s)+H2O(g)?NiO(s)+H2(g)的平衡常数K=2.当水蒸气和氢气的物质的量浓度相等时,此反应( )
| A. | 已达平衡状 | B. | 未达平衡状态,反应正向进行 | ||
| C. | 未达平衡状态,反应逆向进行 | D. | 无法确定 |
17.对于合成氨工业,只从提高原料转化率看,从下列条件中选择最适宜的组合是( )
①高温 ②低温 ③低压 ④高压 ⑤催化剂 ⑥加氨 ⑦除氨.
①高温 ②低温 ③低压 ④高压 ⑤催化剂 ⑥加氨 ⑦除氨.
| A. | ②④⑤ | B. | ②④⑦ | C. | ①④⑤ | D. | ②③⑥ |
1.下列表示物质结构的化学用语或模型图正确的是( )
| A. | HClO的结构式:H-Cl-O | B. | 14C的原子结构示意图: | ||
| C. | 聚氯乙烯的结构简式: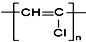 | D. | 丙烷分子的球棍模型示意图: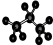 |
2.化学与生活密切相关,下列说法正确的是( )
| A. | 使用填埋法处理未经分类的生活垃圾 | |
| B. | “地沟油”经过加工处理后可用来制肥皂 | |
| C. | 大量使用薪柴为燃料,践行低碳生活 | |
| D. | CO2、NO2或SO2的排放是形成酸雨的主要原因 |
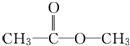
 或
或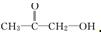 (写出结构简式).
(写出结构简式).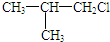 化合物有三个峰,而化合物CH3CH=CHCl却得到氢原子给出的6个信号峰.根据原子在空间的排列方式的不同,写出CH3CH=CHCl 分子的空间异构体:
化合物有三个峰,而化合物CH3CH=CHCl却得到氢原子给出的6个信号峰.根据原子在空间的排列方式的不同,写出CH3CH=CHCl 分子的空间异构体: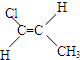
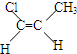 .
.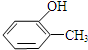 ,
,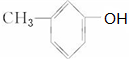 ,
,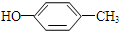 ,对应在PMR谱上观察到氢原子所给出的峰的情况及比例:1:1:1:1:1:3;1:1:1:1:1:3;1:2:2:3.
,对应在PMR谱上观察到氢原子所给出的峰的情况及比例:1:1:1:1:1:3;1:1:1:1:1:3;1:2:2:3.