题目内容
下列图像能正确地表达可逆反应3A(g)+B(g) 2C(g)(△H<0)的是
2C(g)(△H<0)的是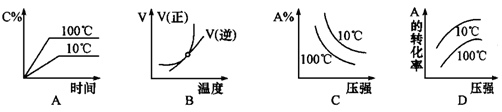
D
解析试题分析:对于可逆反应3A(g)+B(g) 2C(g)△H<0,反应放热,升高温度,正、逆反应速率都增大,逆反应速率增大更多,平衡向逆反应方向移动,则C%降低,A%增大,A的转化率降低。反应物的化学计量数之和大于生成物的化学计量数之和,增大压强,平衡向正反应方向移动,则C%增大,A%降低,A的转化率增大。A、由图象可知,温度升高C%增大,说明升高温度平衡向正反应移动,图象与实际不相符,故A错误;B、由图象可知,温度升高,正反应速率增大比逆反应速率增大更多,平衡向正反应移动,图象与实际不相符,故B错误;C、由图象可知,压强越大A%降低,平衡向正反应移动。升高温度A%降低,平衡向正反应移动,图象与实际不相符,故C错误;D、由图象可知,压强越大A转化率增大,平衡向正反应移动。升高温度A的转化率降低,平衡向逆反应移动,图象与实际相符,故D正确。
2C(g)△H<0,反应放热,升高温度,正、逆反应速率都增大,逆反应速率增大更多,平衡向逆反应方向移动,则C%降低,A%增大,A的转化率降低。反应物的化学计量数之和大于生成物的化学计量数之和,增大压强,平衡向正反应方向移动,则C%增大,A%降低,A的转化率增大。A、由图象可知,温度升高C%增大,说明升高温度平衡向正反应移动,图象与实际不相符,故A错误;B、由图象可知,温度升高,正反应速率增大比逆反应速率增大更多,平衡向正反应移动,图象与实际不相符,故B错误;C、由图象可知,压强越大A%降低,平衡向正反应移动。升高温度A%降低,平衡向正反应移动,图象与实际不相符,故C错误;D、由图象可知,压强越大A转化率增大,平衡向正反应移动。升高温度A的转化率降低,平衡向逆反应移动,图象与实际相符,故D正确。
考点:考查可逆反应图像分析以及外界条件对平衡状态的影响

下列说法正确的是
| A.放热反应一定都是自发的 |
| B.电解池的反应属于自发过程 |
| C.反应能否自发进行与温度有关 |
| D.能自发进行的化学反应,一定是△H>0、△S>0 |
某温度下,X(g)+Y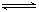 2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
| A.正反应是吸热反应,Z是固体 |
| B.逆反应是放热反应,Y是固体,Z为气体 |
| C.正反应是吸热反应,只有Z不是气体 |
| D.正反应是放热反应,Y和Z均为气体 |
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3,的浓度为
| A.0.50mol/L | B.0.60mol/L | C.0.45mol/L | D.0.55mol/L |
一定量混合物在密闭容器中发生反应:mA(g)+nB(g) pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
| A.m+n<p | B.平衡向逆反应方向移动 | C.A的转化率降低 | D.C的体积分数增大 |
可逆反应2HI(g) H2+I2(g)在密闭容器中装入1molHI气体在一定条件下使它分解,已知有35%发生分解,则容器内混合气体的总物质的量是
H2+I2(g)在密闭容器中装入1molHI气体在一定条件下使它分解,已知有35%发生分解,则容器内混合气体的总物质的量是
| A.1mol | B.0.5mol | C.1.5mol | D.2mol |
下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大,原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A..反应在前50 s的平均速率为v(PCl3)="0.0032" mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)="0.11" mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到平衡时,PCl3的转化率小于80%
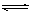 2CO; △H1>0,反应速率ν1 N2+3H2
2CO; △H1>0,反应速率ν1 N2+3H2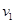 和
和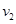 的变化是
的变化是