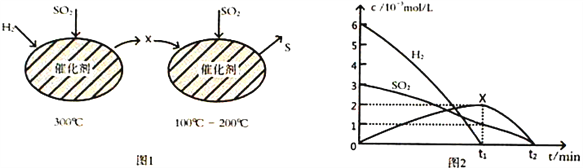
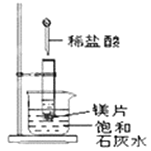
题目内容
【题目】为确认![]() 、
、![]() 、
、![]() 的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:
的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:
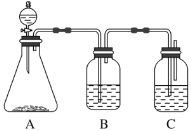
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为________。
(2)装置B所盛的试剂是_____________,其作用是__________________。
(3)装置C所盛试剂是________________,C中反应的离子方程式是____________。
(4)由此得到的结论是酸性:________>________>________。
【答案】盐酸 饱和![]() 溶液 吸收
溶液 吸收![]() 气体
气体 ![]() 溶液
溶液 ![]() ↓
↓![]() (或
(或![]() )
) ![]()
![]()
![]()
【解析】
要确认![]() 、
、![]() 、
、![]() 的酸性强弱,设计的实验流程为HCl→H2CO3→H2SiO3,所以A中反应为2HCl+Na2CO3=2NaCl+H2O+CO2↑,C中反应为Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O==H2SiO3↓+2NaHCO3。由于盐酸易挥发,会干扰CO2与Na2SiO3溶液的反应,所以在反应前,应除去CO2中混有的HCl气体。
的酸性强弱,设计的实验流程为HCl→H2CO3→H2SiO3,所以A中反应为2HCl+Na2CO3=2NaCl+H2O+CO2↑,C中反应为Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O==H2SiO3↓+2NaHCO3。由于盐酸易挥发,会干扰CO2与Na2SiO3溶液的反应,所以在反应前,应除去CO2中混有的HCl气体。
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为酸。
(2)装置B所盛的试剂,应能除去CO2中混有的HCl气体。
(3)装置C中发生反应Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O
==H2SiO3↓+2NaHCO3。
(4)由此可得出酸性的强弱关系。
要确认![]() 、
、![]() 、
、![]() 的酸性强弱,设计的实验流程为HCl→H2CO3→H2SiO3,
的酸性强弱,设计的实验流程为HCl→H2CO3→H2SiO3,
由于盐酸易挥发,会干扰CO2与Na2SiO3溶液的反应,所以在CO2通入硅酸钠溶液前,应除去CO2中混有的HCl气体。
(1)锥形瓶中装某可溶性正盐(通常为Na2CO3)溶液,分液漏斗所盛试剂应为盐酸。答案为:盐酸;
(2)装置B所盛的试剂为饱和NaHCO3溶液,其作用是除去CO2中混有的HCl气体。答案为:饱和![]() 溶液;吸收
溶液;吸收![]() 气体;
气体;
(/span>3)装置C中发生反应Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O
==H2SiO3↓+2NaHCO3。装置C所盛试剂是![]() 溶液,C中反应的离子方程式是SiO32-+CO2+H2O==H2SiO3↓+CO32-或SiO32-+2CO2+2H2O==H2SiO3↓+2HCO3-。
溶液,C中反应的离子方程式是SiO32-+CO2+H2O==H2SiO3↓+CO32-或SiO32-+2CO2+2H2O==H2SiO3↓+2HCO3-。
(4)由此得到的结论是酸性:HCl>H2CO3>H2SiO3。答案为:HCl;H2CO3;H2SiO3。