题目内容
【题目】已知:N2O4(g)![]() 2NO2(g) △H>0,平衡体系中气体的平均摩尔质量(
2NO2(g) △H>0,平衡体系中气体的平均摩尔质量(![]() )在不同温度下随压强的变化曲线如图所示。下列说法正确的是
)在不同温度下随压强的变化曲线如图所示。下列说法正确的是
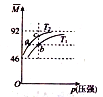
A. 温度:T1<T2 B. 平衡常数:K(a)=K(b)<K(c)
C. 反应速率:v(b)>v(a) D. 当![]() =69g/mol时,n(NO2):n(N2O4)=2:1
=69g/mol时,n(NO2):n(N2O4)=2:1
【答案】C
【解析】
N2O4(g)2NO2(g) △H>0的反应是吸热反应,在压强不变时,升高温度,平衡正向移动,气体的物质的量增大,平衡体系的总质量(m总)与总物质的量(n总)之比减小,温度 T1> T2,A错误;化学平衡常数只与温度有关,而与压强无关;由于a、c在温度T2线上,b在温度T1线上,升高温度化学平衡正向移动,化学平衡常数增大,所以K(a)=K(c) < K(b),B错误;由于b点的温度比a点高,压强比a点大,条件高的速率大,va<vb,C正确;若n(NO2):n(N2O4)=2:1,则m总:n总=(46×2+92)÷3=61.33g/mol<69g/mol,D错误;正确选项C。

练习册系列答案
相关题目