��Ŀ����
����Ŀ���������仯�����ڹ�ũҵ�����ж�����Ҫ���⡣
��1����̬��ԭ�Ӽ۵����Ų��Ĺ����ʾʽΪ_____��
��2��Ԫ��B��N��O�ĵ�һ�������ɴ�С��˳��Ϊ_____��
��3��һ��ʳƷ���Ӽ�NaNO2��NO2������ԭ�ӵ��ӻ�������_____����NO2����Ϊ�ȵ�����ķ��ӵĻ�ѧʽΪ_____��д1�֣�
��4��N2H4�ǻ����ȼ�ϣ�����������Է���������ͬ�����ڳ��³�ѹ����Һ̬������������̬��������ֲ������Ҫԭ����_____��
��5��������һ����ĥͿ�ϣ��������������ı��汣���㣬����������廯������廯���ڸ������������з�Ӧ�ϳɡ�
�����廯���ӵĿռ乹����_____�����廯�������_____��
�������徧����ͼ��ʾ������ʵ����Ϊ��ԭ�ӣ���һ����������ԭ�ӿռ�ѻ���ʽΪ_____����ԭ�ӵ���λ��Ϊ��_____���ýṹ����һ����λ�����ṩ�չ����ԭ����_____����֪�þ����߳�apm�������ӵ�����ΪNA������������ܶ�Ϊ_____gcm��3��

���𰸡� N��O��B sp2 SO2����O3�� N2H4���Ӽ�����ڷ��»��������������O2���Ӽ�ֻ�з��»���������ȷ��»���ǿ�� ������ 120�� �����������ܶѻ� 4 B
N��O��B sp2 SO2����O3�� N2H4���Ӽ�����ڷ��»��������������O2���Ӽ�ֻ�з��»���������ȷ��»���ǿ�� ������ 120�� �����������ܶѻ� 4 B ![]()
��������
��1��PΪ15��Ԫ�أ�����������Ϊ5����̬��ԭ�Ӽ۵����Ų��Ĺ����ʾʽΪ ��
��
��2��ͬһ����Ԫ���У�Ԫ�صĵ�һ����������ԭ����������������������ƣ�����IIA�塢��VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�أ��⼸��Ԫ�ض��ǵڶ�����Ԫ�أ����ǵ��������ֱ��ǣ���IIIA�塢��VA�塢��VIA�壬�������ǵĵ�һ�����ܴ�С˳����N��O��B��
��3��ʳƷ���Ӽ�NaNO2��NO2-����ԭ��N��2��ԭ���������¶Ե��Ӷ���=![]() (5+1-2��2)=1������sp2����NO2-��Ϊ�ȵ�����ķ�����SO2��O3���ʴ�Ϊ��sp2�ӻ���SO2��O3��
(5+1-2��2)=1������sp2����NO2-��Ϊ�ȵ�����ķ�����SO2��O3���ʴ�Ϊ��sp2�ӻ���SO2��O3��
(4) N2H4���Ӽ���������O2���Ӽ�ֻ�з��»���������ȷ��»���ǿ�������ڳ��³�ѹ��N2H4��Һ̬������������̬���ʴ�Ϊ: N2H4���Ӽ���������O2���Ӽ�ֻ�з��»���������ȷ��»���ǿ��
(5)�����廯��������ԭ�ӵļ۲���Ӷ���Ϊ![]() ��Pԭ�Ӱ�sp3��ʽ�ӻ�����һ�Թµ��Ӷԣ����Է��ӿռ乹��Ϊ�����Σ����廯���������ԭ�ӵļ۲���Ӷ���Ϊ
��Pԭ�Ӱ�sp3��ʽ�ӻ�����һ�Թµ��Ӷԣ����Է��ӿռ乹��Ϊ�����Σ����廯���������ԭ�ӵļ۲���Ӷ���Ϊ![]() �� Bԭ�Ӱ�sp2��ʽ�ӻ���û�йµ��Ӷԣ����Է��ӿռ乹��Ϊƽ�������Σ��ṹʽΪ
�� Bԭ�Ӱ�sp2��ʽ�ӻ���û�йµ��Ӷԣ����Է��ӿռ乹��Ϊƽ�������Σ��ṹʽΪ![]()
�������� 120�����ʴ�Ϊ�������Σ�120����
�ڸ��������徧���ṹͼ����һ����������ԭ�ӿռ�ѻ���ʽΪ�����������ܶѻ�����������ԭ�Ӻ���ԭ�Ӷ���4����B����λ��Ϊ4,��P����λ��ҲΪ4,�ýṹ����һ����λ����Bԭ���������3�����ӣ��ṩ�չ����ԭ����B.��������ԭ�Ӻ���ԭ�Ӷ���4���������ܶ�= ��
��

 �߲������Ӧ��һ��ͨϵ�д�
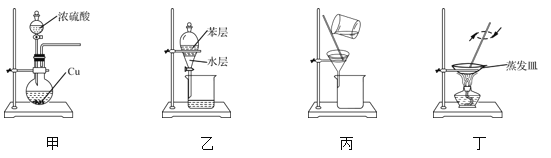
�߲������Ӧ��һ��ͨϵ�д�����Ŀ����ͼ��ʾ��ij��ѧ��ȤС�������һ��ȼ�ϵ�أ���̽���ȼҵԭ���ʹ�ͭ����ԭ����������װ����XΪ�����ӽ���Ĥ������Ҫ��ش��������:

(1)ͨ�������ĵ缫Ϊ_____(�������������)��ͨ����һ���ĵ缫��ӦʽΪ_________________��
(2)���缫Ϊ_______(���������������)����װ���е�ⷴӦ�Ļ�ѧ����ʽΪ_________________��
(3)���ڱ�״���£���1.12 L�����μӷ�Ӧ����װ�����������ص�����Ϊ______g��
(4)ij��ͭ�к������������Ͳ������ʣ�ͨ����⾫�ƺ�Ϊ�ӵ��Һ���Ƶ�����ͭ����(CuSO4��5H2O),��������¹�������:

��֪:���ֽ��������ӿ�ʼ�����ͳ�����ȫ��pH:
�������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
�ٲ���I�м����Լ�A��Ŀ����_____________________________���Լ�AӦѡ��______(�����);
a.���� b.�������� C.���Ը��������Һ
ѡ����Լ���ԭ��_____________________________________________________��
�ڲ���II���Լ�BΪ_________������pH�ķ�Χ��___________��
�۲���III�IJ����Ǽ���Ũ����_______��___________��
����Ŀ����100��ʱ����0.2molN2O4(g)����2L�ĺ����ܱ������У����һ��ʱ���Ը������ڸ����ʵ����ʵ������вⶨ,�õ���������:
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
N(N2O4)/mol | 0.20 | n1 | 0.10 | n3 | n4 |
N(NO2)/mol | 0.00 | 0.12 | n2 | 0.24 | 0.24 |
(1)�÷�Ӧ��ƽ�ⳣ������ʽΪ___________________________���ɱ������ݷ����ɵã�n1=____mol��n3=________________mol��
(2)�����������£���0��40s��NO2��ƽ����Ӧ����Ϊ___________________��
(3)�÷�Ӧ�ﵽ��ѧƽ������иı��ʹN2O4Ũ���������_____(�����);
A.�����������ݻ� B.�������г���һ������NO2
C.���������ٳ���һ������N2O4 D.�������г���һ������He(g)
(4)����ͼ�л����˷�Ӧ��N2O4��Ũ����ʱ��仯������_________��