题目内容
【题目】常温下,向盛有1 L 0.1 mol·L-1NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是
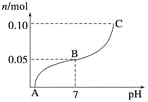
A. A点时pH=1
B. 恰好完全沉淀时Ba(OH)2的体积为2 L
C. B点时,溶液中的离子浓度关系为c(Na+)>c(SO![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
D. C点时pH=14
【答案】D
【解析】0.1 mol·L-1NaHSO4溶液中c(H+)=0.1 mol·L-1,pH=1,A正确;往NaHSO4溶液中滴加Ba(OH)2反应过程为①2NaHSO4+Ba(OH)2===BaSO4↓+Na2SO4+2H2O(中性),继续加入Ba(OH)2溶液,Na2SO4+Ba(OH)2===BaSO4↓+2NaOH,总反应为②NaHSO4+Ba(OH)2===BaSO4↓+NaOH+H2O,故恰好完全沉淀时,n(NaHSO4)=n[Ba(OH)2],由此求出Ba(OH)2体积为2 L,B正确;B点时发生反应①,溶质为Na2SO4,pH=7,C正确;C点时发生反应②,n(OH-)=1×0.1=0.1 mol,但溶液体积为3 L,
c(OH-)=![]() ≈0.033 mol·L-1,pH≠14,D错
≈0.033 mol·L-1,pH≠14,D错

【题目】(I)工业上过氧化氢是重要的氧化剂和还原剂。常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:____________________________。
(2)同学们用0.1000mol/L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被_________(填“氧化”或“还原”)。
②滴定到达终点的现象是____________________________。
③用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为__________mol/L-1。
(II)医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。测定含量如下:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀疏酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
(1)滴定时,用_____(填酸或碱)式滴定管装KMnO4溶液。
(2)下列操作会引起测定结果偏高的是______。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.锥形瓶未用待测液润洗
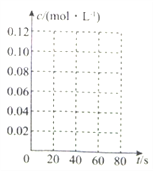
【题目】在100℃时,将0.2molN2O4(g)充入2L的恒容密闭容器中,间隔一定时间后对该容器内各物质的物质的量进行测定,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
N(N2O4)/mol | 0.20 | n1 | 0.10 | n3 | n4 |
N(NO2)/mol | 0.00 | 0.12 | n2 | 0.24 | 0.24 |
(1)该反应的平衡常数表达式为___________________________,由表中数据分析可得,n1=____mol,n3=________________mol;
(2)在上述条件下,从0到40s内NO2的平均反应速率为___________________;
(3)该反应达到化学平衡后,下列改变可使N2O4浓度增大的是_____(填序号);
A.增大容器的容积 B.向容器中充入一定量的NO2
C.向容器中再充入一定量的N2O4 D.向容器中充入一定量的He(g)
(4)在下图中画出此反应中N2O4的浓度随时间变化的曲线_________。