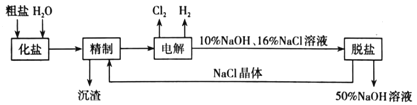
��Ŀ����
����Ŀ����ҵ���������������ϴ�������Ҫ�ɷ�ΪAl2O3������������Pd(��)����������������Pd���������£�
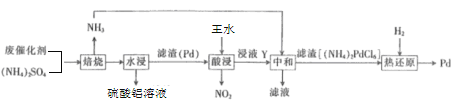
�ش��������⣺
��1������������Һ����Ũ������ȴ�õ�ʮ��ˮ�����������壬�ù���Ļ�ѧʽΪ___��
��2������ʱAl2O3��(NH4)2SO4��Ӧ�Ļ�ѧ����ʽΪ___��
��3����ˮ��Ũ�����Ũ���ᰴ�����Ϊ___�Ļ�����ˮ���ȶ�������ʱ��������������(NOCl)���������÷�Ӧ�Ļ�ѧ����ʽΪ___��
��4����ҺY�к�PdԪ�ص�������H2PdCl6(������)���������ʱ��Ӧ�Ļ�ѧ����ʽΪ___��
��5�������Ȼ�ԭ���еõ��Ĺ���ֻ��Pd��ÿ����1molPdʱ���ɵ���������ʵ���Ϊ___��
��6��Pd�������Ĵ���������䴢��ԭ��Ϊ2Pd��s��+xH2��g���T2PdHx��s��������x�����ֵΪ0.8����֪��Pd���ܶ�Ϊ12gcm��3����21.2cm3Pd�ܴ����״����H2��������Ϊ___L��
���𰸡�Al2(SO4)3��18H2O 3(NH4)2SO4+Al2O3![]() Al2(SO4)3+6NH3��+3H2O�� 1��3 HNO3(Ũ) +3HCl(Ũ)
Al2(SO4)3+6NH3��+3H2O�� 1��3 HNO3(Ũ) +3HCl(Ũ)![]() NOCl��+Cl2��+2H2O Pd+6HCl+4HNO3=H2PdCl6+4NO2��+4H2O 8mol 21.504
NOCl��+Cl2��+2H2O Pd+6HCl+4HNO3=H2PdCl6+4NO2��+4H2O 8mol 21.504
��������
�ϴ���������立�Ӧ���ɰ�����������������Pd����ˮ��Ӧ����������ԭ��Ӧ����д����ʽ���Լ���ˮ���Ӧ��������֪��Ϣд��(NH4)2PdCl6 ��H2��Ӧ�ó�������������ʵ����������ù�ϵʽ����Pd���������������
�Ž���������Һ����Ũ������ȴ�õ�ʮ��ˮ�����������壬�ᾧˮд�����Ҫ��СԲ��������ù���Ļ�ѧʽΪAl2(SO4)3��18H2O��
�ʴ�Ϊ��Al2(SO4)3��18H2O��
�Ƹ��� ǰ����ϵ���ó�����ʱAl2O3��(NH4)2SO4��Ӧ�Ļ�ѧ����ʽΪ3(NH4)2SO4+Al2O3
ǰ����ϵ���ó�����ʱAl2O3��(NH4)2SO4��Ӧ�Ļ�ѧ����ʽΪ3(NH4)2SO4+Al2O3![]() Al2(SO4)3+6NH3��+3H2O����
Al2(SO4)3+6NH3��+3H2O����
�ʴ�Ϊ��3(NH4)2SO4+Al2O3![]() Al2(SO4)3+6NH3��+3H2O����
Al2(SO4)3+6NH3��+3H2O����
����ˮ��Ũ�����Ũ���ᰴ�����Ϊ1:3�Ļ�����ˮ���ȶ�������ʱ��������������(NOCl)��������HNO3(Ũ)���ϼ۽��ͱ�ΪNOCl�������ữ�ϼ����߱�Ϊ��������˸÷�Ӧ�Ļ�ѧ����ʽΪHNO3(Ũ) +3HCl(Ũ)![]() NOCl��+Cl2��+2H2O��
NOCl��+Cl2��+2H2O��
�ʴ�Ϊ��HNO3(Ũ) +3HCl(Ũ)![]() NOCl��+Cl2��+2H2O��
NOCl��+Cl2��+2H2O��
�Ƚ�ҺY�к�PdԪ�ص�������H2PdCl6(������)���ٸ���ͼ����Ϣ��������H2PdCl6(������)��ͬʱ�������˶�������������������ʱ��Ӧ�Ļ�ѧ����ʽΪPd+6HCl+4HNO3 = H2PdCl6+4NO2��+4H2O��
�ʴ�Ϊ��Pd+6HCl+4HNO3=H2PdCl6+4NO2��+4H2O��
�������Ȼ�ԭ���еõ��Ĺ���ֻ��Pd������(NH4)2PdCl6 + 2H2 = Pd + 6HCl��+ 2NH3����Ӧ��ÿ����1mol Pdʱ���ɵ���������ʵ���Ϊ8 mol��
�ʴ�Ϊ��8 mol��
��Pd�������Ĵ���������䴢��ԭ��Ϊ2Pd��s��+xH2��g���T2PdHx��s��������x�����ֵΪ0.8����֪��Pd���ܶ�Ϊ12gcm��3����21.2cm3Pd����m = 21.2cm3��12gcm��3=254.4g�������ʵ���![]() ��
��
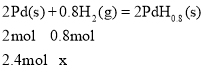
���x = 2.4mol0.8mol��2mol=0.96 mol
�ܴ����״����H2��������Ϊ![]() ��
��
�ʴ�Ϊ21.504 L��

����Ŀ���й���ͳ�Ļ��а�������Ƽ�֪ʶ�����й��������漰��ѧ�仯����
ǧ�����������࣬������ɳʼ���� |
������(CuSO4��5H2O) ��������֮�Ϊͭ |
��ʯ��(CaCO3)�� �������Ϊ�� |
��ɰ(HgS)��֮��ˮ���������ֳɵ�ɰ |
A | B | C | D |
A. A B. B C. C D. D