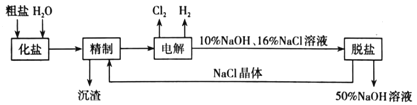
题目内容
【题目】水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
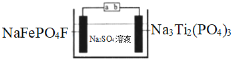
下列说法错误的是
A.充电时,a接电源正极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
【答案】B
【解析】
2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
分析方程式得出NaFePO4F变为Na2FePO4F,Fe在降低,发生还原反应,该物质作原电池的正极,Na3Ti2(PO4)3变为NaTi2(PO4)3,Ti在升高,发生氧化反应,该物质作原电池的负极。
A选项,放电时a为正极,因此充电时,a接电源正极,故A正确;
B选项,放电时,溶液中的Na+不放电,而是Na3Ti2(PO4)3中Ti在失去电子,故B错误;
C选项,阴极主要是NaTi2(PO4)3得到电子,因此阴极上的电极反应为NaTi2(PO4)3+ 2Na+ + 2e- =Na3Ti2(PO4)3,故C正确;
D选项,根据溶液中电荷守恒关系,理论上,该电池在充电或放电过程中溶液中的c(Na+)不变,故D正确;
综上所述,答案为B。

 口算能手系列答案
口算能手系列答案【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列热化学方程式不正确的是 ( )
A.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=-91.5 kJ/mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol
D.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=+91.5 kJ/mol