题目内容
【题目】将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是 ( )
A. 2.24g B. 3.36g C. 5.60g D. 10.08g
【答案】C
【解析】
分析:反应后溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可以知道残留物没有Fe,只有Cu,而Cu可以残留说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,参加反应的HCl中的H元素转化到氢气、水中,根据H原子守恒,计算混合物中O原子物质的量,根据Cu元素守恒计算n(CuO),再根据O原子守恒计算n(Fe2O3),根据m=n![]() M计算氧化铁的质量。
M计算氧化铁的质量。
反应后溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可以知道残留物没有Fe,只有Cu,而Cu可以残留说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,反应后剩余n(H+)=0.4nol/L×0.2L=0.08mol,原溶液中n(HCl)=4.4mol/L×0.1L=0.44mol,参加反应的HCl中的H元素转化到氢气、水中,
根据H原子守恒,2n(H2O)+2n(H2)=n总(HCl)-n余(H+),即2n(H2O)+2![]() =0.44mol-0.08mol,n(H2O)=0.14mol故混合物中n(O)= n(H2O)=0.14mol,
=0.44mol-0.08mol,n(H2O)=0.14mol故混合物中n(O)= n(H2O)=0.14mol,
由铜元素守恒,则n(CuO)=n(Cu)=![]() =0.02mol,
=0.02mol,
由O原子守恒:3n(Fe2O3)+ n(CuO)=0.14mol,则n(Fe2O3)=0.04mol,
由Cl原子守恒,滤液中溶质为FeCl2和剩余HCl,2n(FeCl2)+n余(HCl)=n总(HCl),即2n(FeCl2)+0.08mol=0.44mol,n(FeCl2)=0.18mol,
由Fe原子守恒,原混合物中铁的物质的量:n(Fe)+2n(Fe2O3)=n(FeCl2), n(Fe)=0.18mol-0.04mol×2=0.10mol, m(Fe)=0.10mol×56g/mol=5.60g,
所以C选项是正确的。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】1 L某混合溶液,可能含有的离子如下表:
阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)向该溶液中逐滴加入cmol/L NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定含有的离子是______________。
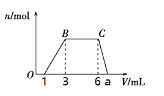
(2)根据图像数据计算a=_______________mL
(3)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | x mol(x≠0) | 0 | 0 |
①当通入Cl2的体积为5.6L时,溶液中发生反应的离子方程式为______________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________________。
③x=_________________mol
【题目】中学化学中下列各物质间不能实现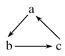 (“→”表示一步完成)转化的是
(“→”表示一步完成)转化的是
选项 | A | B | C | D |
a | CH3CH2OH | CH2=CH2 | Cl2 | C |
b | CH3CHO | CH3CH2Br | HClO | CO |
c | CH3COOH | CH3CH2OH | HCl | CO2 |
A. AB. BC. CD. D