题目内容
17.下列解释实验事实的离子方程式正确的是( )| A. | 稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ | |
| B. | 用大理石与稀盐酸制备二氧化碳:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| C. | 用氢氧化钠溶液吸收氯气:Cl2+2OH-=ClO-+Cl-+H2O | |
| D. | 铜片放入稀硝酸中产生气体:Cu+4H++2NO${\;}_{3}^{-}$=Cu2++2NO2↑+2H2O |
分析 A.漏掉氢氧根离子与氢离子的反应;
B.碳酸钙为沉淀,应保留化学式;
C.二者反应生成氯化钠和次氯酸钠和水;
D.不符合反应客观事实,铜与稀硝酸反应生成一氧化氮.
解答 解:A.稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A错误;
B.碳酸钙与盐酸反应的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C.用氢氧化钠溶液吸收氯气,离子方程式:Cl2+2OH-=ClO-+Cl-+H2O,故C正确;
D.铜片放入稀硝酸中产生气体,离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故D错误;
故选:C.
点评 本题考查了离子方程式正误判断,明确发生的化学反应是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
14.下列有机物分子中,相邻的五个原子可以构成一个正四面体的是( )
| A. | CHCl3 | B. | CH(CH3) 3 | C. | CCl4 | D. | CH3CH3 |
5.将贮满某种干燥气体的试管倒置于滴有酚酞的水中,轻轻摇晃后,水可以充满试管且溶液变成红色.该气体可能是( )
| A. | NO2 | B. | N2 | C. | SO2 | D. | NH3 |
12.下列关于Cl2性质的说法正确的是( )
| A. | 密度比空气小 | B. | 是无色无味的气体 | ||
| C. | 能使干燥的有色布条褪色 | D. | 可与NaOH溶液反应 |
2.下列说法正确的是( )
| A. | 光导纤维、防弹玻璃、氧化铝陶瓷、硅藻土都是无机非金属材料,PLA、PE、橡胶、酚醛树脂都是人工合成高分子材料 | |
| B. | 贮氢金属并不是简单地吸附氢气,而是通过化学反应贮存氢气 | |
| C. | 科学家发现一种新的CO2晶体,该CO2晶体具有极强的硬度,是由CO2分子构成的空间立体网状结构 | |
| D. | 最新的氯碱工业是用离子交换膜电解槽电解饱和食盐水来生产氢气、氯气和烧碱的,电解槽中的离子交换膜既可以用阳离子交换膜也可以用阴离子交换膜 |

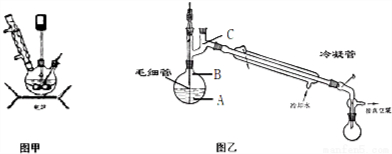 水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途.用尿素法制水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:CO (NH2)2+NaClO+2NaOH→H2N-NH2•H2O+NaCl+Na2CO3.
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途.用尿素法制水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:CO (NH2)2+NaClO+2NaOH→H2N-NH2•H2O+NaCl+Na2CO3.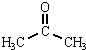 +CH3COOH
+CH3COOH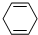
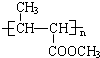 有一种合成这种高聚物的途径副产物污染少或无污染,原子利用率较高,符合“绿色化学挑战计划”的要求,其合成路线如下:
有一种合成这种高聚物的途径副产物污染少或无污染,原子利用率较高,符合“绿色化学挑战计划”的要求,其合成路线如下: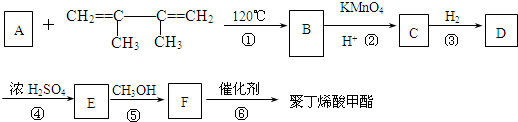
 C:
C: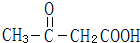
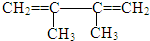 的系统命名名称是2,3-二甲基-1,3-丁二烯,反应⑥属于加聚反应(填反应类型)
的系统命名名称是2,3-二甲基-1,3-丁二烯,反应⑥属于加聚反应(填反应类型)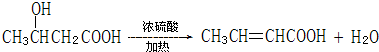 反应⑤:
反应⑤: