题目内容
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1) SO2和NOx在空气中存在下列平衡:
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJ·mol-1
2NO2(g) △H=-113.0kJ·mol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为________________________________________。
②随温度升高,该反应化学平衡常数变化趋势是______(填“增大”、“减小”、“不变”或“不能确定”)。
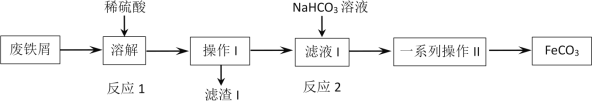
(2)工业上利用氯碱工业产品治理含二氧化硫的废气如图是氯碱工业中电解饱和食盐水的原理示意图
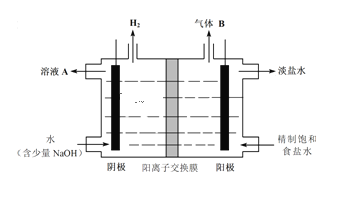
①电解饱和食盐水的化学方程式是_______________________________________________。
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_______________________。
③用含气体B溶液吸收含二氧化硫的废气,其反应的离子方程式是__________________。
【答案】NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8 kJ·mol-1 减小 2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ SO2+2OH-=SO32-+H2O或SO2+OH-=HSO3- SO2+Cl2+2H2O=SO42-+2Cl-+4H+
2NaOH+Cl2↑+H2↑ SO2+2OH-=SO32-+H2O或SO2+OH-=HSO3- SO2+Cl2+2H2O=SO42-+2Cl-+4H+
【解析】
(1)①根据盖斯定律求反应热;②温度与平衡常数的关系;
(2)电解饱和食盐水,得到NaOH、H2、Cl2;阴极区,H2O得到电子生成氢气和OH-,溶液A为NaOH,吸收SO2得到亚硫酸盐;气体B为氯气,与SO2发生氧化还原反应。
(1)①SO2和NO2的反应方程式NO2+SO2=SO3+NO,根据盖斯定律等于![]() (反应②-反应①),则△H=
(反应②-反应①),则△H=![]() (△H2-△H1)=
(△H2-△H1)=![]() ×[-196.6-(-113.0)] kJ·mol-1=-41.8 kJ·mol-1;热化学方程式为NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8 kJ·mol-1;
×[-196.6-(-113.0)] kJ·mol-1=-41.8 kJ·mol-1;热化学方程式为NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8 kJ·mol-1;
②根据①中的计算,该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小;
(2)①电解饱和食盐水,阴极为水电离出的H+得电子,生成H2,剩余OH-;阳极为Cl-失去电子,生成Cl2,总反应方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;
②溶液A为NaOH溶液,SO2为酸性氧化物,酸性氧化物与碱发生反应得到盐和水。SO2少量时,离子方程式为SO2+2OH-=SO32-+H2O;若SO2过量,得到酸式盐,离子方程式为SO2+OH-=HSO3-;
③气体B为Cl2,具有强氧化性,SO2具有还原性,发生氧化还原反应,1molCl2中的Cl的化合价从0降低到-1,生成Cl-,有2molCl,总共得到2mol电子;SO2被氧化生成H2SO4,1molSO2,其S的化合价从+4升高到+6,总共失去2mol电子,得失电子守恒,Cl2和SO2的比例为1:1,根据电荷守恒和原子守恒,配平方程式,有SO2+Cl2+2H2O=SO42-+2Cl-+4H+。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验主要仪器和试剂的选择不能达到实验目的的是
选项 | 主要仪器 | 试剂 | 实验目的 |
A | 烧瓶、长颈漏斗、酒精灯、导管 | 软锰矿与浓盐酸 | 制取并收集干燥的氯气 |
B | 酒精灯、玻璃棒、蒸发皿、三脚架 |
| 蒸发溶液得到晶体 |
C | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的氨气、水 | 模拟喷泉实验 |
D | 铁丝、蓝色钴玻璃、酒精灯 | 盐酸、待测液 | 焰色反应实验 |
A.AB.BC.CD.D
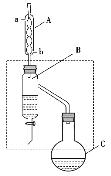
【题目】乙酸丁酯是重要的化工原料。实验室用乙酸、丁醇在浓硫酸作催化剂、加热条件下制备乙酸丁酯的装置示意图(加热和夹持装置已省略)和有关信息如下:
乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
下列说法正确的是( )
A.加热一段时间后,发现烧瓶C中忘记加沸石,可打开瓶塞直接加入即可
B.装置B的作用是不断分离出乙酸丁酯,提高产率
C.装置A可以装配蒸馏装置的冷凝器,且冷凝水由a口进,b口出
D.乙酸丁酯中残留的乙酸和正丁醇可用饱和碳酸钠溶液除去