题目内容
17.下列事实不能用电化学原理解释的是( )| A. | 常温条件下,在空气中铝不容易被腐蚀 | |
| B. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| C. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| D. | 远洋海轮的尾部装上一定数量的锌板 |
分析 金属的电化学腐蚀涉及原电池反应,金属的防护涉及原电池或电解池反应,题中合金以及金属的腐蚀与防护常涉及电化学原理,以此解答该题.
解答 解:A.铝片在空气中被O2氧化,使铝片表面形成一层致密的氧化物薄膜而保护内层的铝不再被氧化,所以铝片不用特殊方法保存,此现象与电化学知识无关,故A选;
B.锌、铁和电解质溶液能构成原电池,锌易失电子被腐蚀,铁作正极被保护,锡、铁和电解质溶液能构成原电池,铁易失电子而作负极,加速被腐蚀,所以镀层被划破后,镀锌的铁制品比镀锡的铁制品耐腐蚀,所以可以用电化学原理解释,故B不选;
C.铁比银活泼,镀银的铁制品,镀层部分受损后,易发生电化学腐蚀,露出的铁表面易被腐蚀,故C选;
D.加锌后,金属性Zn>Fe,构成原电池,Zn易被腐蚀,故D不选;
故选A.
点评 本题考查原电池,明确发生的化学反应及电化学反应为解答本题的关键,注意原电池中负极易被腐蚀,题目难度不大.

练习册系列答案
相关题目
13.当铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率增大的是( )
| A. | 不用稀硫酸,改用98%的浓硫酸 | B. | 加热 | ||
| C. | 适当增大稀硫酸的浓度 | D. | 不用铁片,改用铁粉 |
14.关于下列变化的比较,正确的是( )
| A. | 氢化物稳定性:HI>HBr>HCl>HF | |
| B. | 酸性强弱:HNO3>H3PO4>H2SO4 | |
| C. | 离子半径由大到小:O2->F->Na+>Mg2+ | |
| D. | 碱性强弱:RbOH<KOH<NaOH<LiOH |
5.2011年3月11日福岛核电站遭受地震损坏而发生了核泄漏,其中核泄露的一种放射源是碘-131,下列说法不正确的( )
| A. | 碘-131原子核外有5个电子层 | |
| B. | 碘-131原子的最外层有7个电子 | |
| C. | 具有放射性的碘-131原子比普通碘-127原子多4个中子 | |
| D. | 131I2与127I2互为同位素 |
9.漆酚 是我国特产漆的主要成分,下列叙述错误的是( )
是我国特产漆的主要成分,下列叙述错误的是( )
 是我国特产漆的主要成分,下列叙述错误的是( )
是我国特产漆的主要成分,下列叙述错误的是( )| A. | 能与FeCl3溶液发生显色反应,但不能发生加成反应 | |
| B. | 能和浓溴水发生取代反应,能与碳酸钠溶液反应生成CO2 | |
| C. | 可以使高锰酸钾溶液褪色 | |
| D. | 可以与甲醛发生缩聚反应 |
6.下列说法中错误的是( )
| A. | 乙醇与金属钠反应时,是乙醇分子中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水可加入少量无水硫酸铜,若变蓝色则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 甲烷、乙烯、苯、乙酸都是无色不溶于水的有机化合物 |
7.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大.小组成员为此“异常”现象展开讨论.猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证.
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:生成的Mn2+在反应中起到催化剂的作用,加快了反应速率
【实验目的】探究草酸与高锰酸钾反应的速率变化“异常”原因;
【实验用品】仪器:试管、胶头滴管、量筒、药匙、玻璃棒等;
试剂:0.1mol/LH2C2O4溶液、0.05mol/LKMnO4(硫酸酸化)溶液等.
请你根据该兴趣小组的实验探究设计思路,补充完整所缺内容.
(1)KMnO4溶液可用硫酸酸化,而为什么不能用盐酸酸化,请用离子方程式进行说明:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是温度计.
(4)要设计实验验证猜想Ⅱ,进行该实验还要补充的一种试剂是MnSO4(s),一种仪器是秒表.
(5)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
(6)结晶水合草酸成品的纯度用高锰酸钾法测定.称量草酸成品0.250g溶于水,用0.0500mol•L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00mL,反应的计算该成品的纯度.
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:生成的Mn2+在反应中起到催化剂的作用,加快了反应速率
【实验目的】探究草酸与高锰酸钾反应的速率变化“异常”原因;
【实验用品】仪器:试管、胶头滴管、量筒、药匙、玻璃棒等;
试剂:0.1mol/LH2C2O4溶液、0.05mol/LKMnO4(硫酸酸化)溶液等.
请你根据该兴趣小组的实验探究设计思路,补充完整所缺内容.
(1)KMnO4溶液可用硫酸酸化,而为什么不能用盐酸酸化,请用离子方程式进行说明:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是温度计.
(4)要设计实验验证猜想Ⅱ,进行该实验还要补充的一种试剂是MnSO4(s),一种仪器是秒表.
(5)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
| 对比实验 | 试管A | 试管B |
| 加入试剂 | 1ml0.05mol/l KMnO4 2ml0.1mol/l H2C2O4 | 1ml0.05mol/lKMnO4 2ml0.1mol/lH2C2O4 少量MnSO4 |
| (预期)实验现象 (褪色时间) | 褪色较慢 | 褪色很快 |
| 结论 | 猜想Ⅱ正确 | |
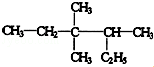 3,3,4-三甲基已烷分子结构中有1个手性碳原子.
3,3,4-三甲基已烷分子结构中有1个手性碳原子. ,
,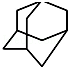 的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升.
的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升.