��Ŀ����
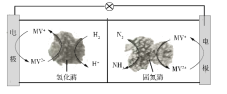
����Ŀ���綯�������õ��Ϊ����﮵�أ�����ʱԭ����ͼ��N�������ǽ���﮺�̼�ĸ��ϲ��ϣ������Ϊһ���ܴ���Li+�Ĺ������ʣ���ط�Ӧʽ��
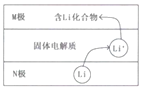
LixC6+Li1-xCoO2![]() C6+LiCoO2������˵��������ǣ�������
C6+LiCoO2������˵��������ǣ�������
A.�ŵ�ʱ���Ӵ�N������M��
B.�ŵ�ʱN�缫�ķ�ӦʽΪ��LixC6��xe��=xLi++C6
C.M�������ʾ��н�ǿ��ԭ��
D.����ڴ�ͳǦ���أ�﮵�صı������ϸ�
���𰸡�C
��������
���ݵ�ط�Ӧʽ֪���ŵ�ʱ������ӦʽΪLixC6��xe��=C6+xLi+��������ӦʽΪLi1-xCoO2+xLi++xe��=LiCoO2�����ʱ��������������Ӧʽ�븺����������Ӧʽ�����෴������N�Ǹ�����M��������
A���ŵ�ʱ���ӴӸ�����������������N��ͨ����������M������A��ȷ��
B���ŵ�ʱ��N�Ǹ���������ʧ���ӵ�������Ӧ���缫��ӦʽΪ��LixC6��xe��=C6+xLi+����B��ȷ��
C��M������������Ҫ���н�ǿ��ԭ�ԣ���C����
D����λ�������������Խ�࣬�������Խ�����Ԫ�ص�Ħ��������С����������ڴ�ͳǦ���أ�﮵�صı������ϸߣ���D��ȷ��
������������ΪC��

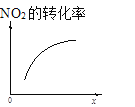
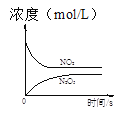
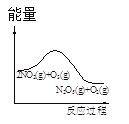
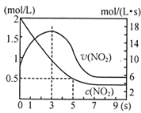
����Ŀ����������������������Լ�����������ӦΪ��2NO2(g)+O3(g)N2O5(g)+O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ����
A | B | C | D |
|
|
|
|
t1ʱ�����������ƽ�����������ƶ� | ��ƽ��ʱ�����ı�x����xΪc(O2) | �ӷ�Ӧ��ʼ��ƽ������Ũ�ȱ仯 | �����¶ȣ�ƽ�ⳣ����С |
A.AB.BC.CD.D
����Ŀ����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������Ӧ��X��g��+Y��g��2Z��g����H��0��һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ���������������˵����ȷ���ǣ�������
t�Mmin | 2 | 4 | 7 | 9 |
n��Y���Mmol | 0.12 | 0.11 | 0.10 | 0.10 |
A. ��Ӧǰ4min��ƽ����Ӧ��������Z��=0.0125molL-1min-1
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ�����棩����������
C. �����������䣬�ٳ���0.2molZ����ƽ��ʱX�������������
D. ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44