题目内容
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H =" +" 74.9 kJ·mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
A
解析试题分析:A.根据反应方程式可知:该反应中熵变、焓变皆大于0 ,正确;B.该反应是吸热反应,但是由于是体系的混乱程度增大的反应,所以在一定温度下也有可能自发进行 ,错误;C.碳酸盐分解反应中熵增加,因此在一定条件下若ΔG<0则碳酸盐分解也可能自发进行,错误;D.能自发进行的反应不一定是放热反应,不能自发进行的反应也不一定是吸热反应,错误。
考点:考查关于自发反应与焓变、熵变的关系的知识。

 名校课堂系列答案
名校课堂系列答案I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s) + 3C(石墨)="2Fe(s)" + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
则△H___________________(用含△H1 、△H2的代数式表示)。
(2)高炉炼铁反应的平衡常数表达式K=____________________________。
(3)在某温度时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为_______________________。
②下列说法正确的是____________________(填编号)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
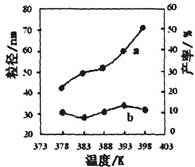
II.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 4 | 3∶1 | 实验②和④探究________ ______________________ 实验②和__________探究 反应时间对产率的影响。 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | _______ | |
| ④ | 398 | 4 | 4∶1 |
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响规律(写出一条):
___________________________________________。
下列关于化学反应限度的说法中正确的是( )
| A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 |
| B.当一个可逆反应进行到平衡状态时,这个反应的正向反应速率和逆向反应速率为零 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度不再改变 |
| D.化学反应的限度不可以通过改变条件而发生改变 |
一定条件下密闭容器中发生如下反应:N2(g)+3H2(g)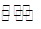 2NH3(g),能说明该反应达到化学平衡状态的是 ( )
2NH3(g),能说明该反应达到化学平衡状态的是 ( )
| A.N2、H2、NH3的浓度相等 |
| B.N2、H2、NH3的浓度不再变化 |
| C.N2、H2、NH3在密闭容器中共存 |
| D.反应停止,正、逆反应速率都等于零 |
向恒温、恒容(2L)的密闭容器中充入2molX和一定量的Y,发生反应:2X(g)+Y(g)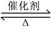 2Z(g)
2Z(g)
ΔH<0,4min后达到平衡c(X)=0.2mol·L-1,且X与Y的转化率相等。下列说法中不正确的是( )
| A.达到平衡时,再充入1molX,反应的焓变保持不变 |
| B.用Y表示4min内的反应速率为0.1 mol·L-1·min-1 |
| C.再向容器中充入1molZ,达到新平衡,c(X)∶c(Y)=2∶1 |
| D.4min后,若升高温度,平衡常数K增大 |
符合下列情况的化学反应一定能自发进行的是
| A.△H<0、△S>0 | B.△H<0、△S<0 |
| C.△H>0、△S<0 | D.△H>0、△S>0 |
下列实验中,反应速率加快属于由催化剂引起的是
| A.氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 |
| B.过氧化氢中加入几滴氯化铁溶液,可较快放出气体 |
| C.在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 |
| D.用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
 2C(g)+2D(s)达到平衡,下列描述一定正确的是
2C(g)+2D(s)达到平衡,下列描述一定正确的是 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )