题目内容
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s) + 3C(石墨)="2Fe(s)" + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
则△H___________________(用含△H1 、△H2的代数式表示)。
(2)高炉炼铁反应的平衡常数表达式K=____________________________。
(3)在某温度时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为_______________________。
②下列说法正确的是____________________(填编号)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
II.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 4 | 3∶1 | 实验②和④探究________ ______________________ 实验②和__________探究 反应时间对产率的影响。 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | _______ | |
| ④ | 398 | 4 | 4∶1 |
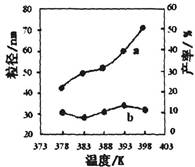
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响规律(写出一条):
___________________________________________。
(16分)I.(1)△H1 -3△H2(2分)
(2)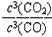 (3分) 注:用“[ ]”表示平衡浓度的也给分
(3分) 注:用“[ ]”表示平衡浓度的也给分
(3)①60%(2分) ②B(2分)
II. 4∶1(1分) 温度对产率的影响(2分) ③(1分)
在378~398K(1分),生成的纳米MgO的粒径大小无明显变化(合理则给分)(2分)
或者:在378K~398K(1分或在实验温度下也得分),随温度的升高,产率增大(2分)
383K较低温度下有利于形成较小的颗粒(3分)
注:填“在实验温度下”也得分。
解析试题分析:(1)观察已知热化学方程式,根据盖斯定律,可以用①-②×3约去3C(石墨),得到高炉炼铁的反应式,则Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g)的△H =①的焓变-②的焓变×3=△H1 -3△H2;(2)根据平衡常数的概念,由于固体物质或纯液体的浓度是常数,不能写进表达式,则高炉炼铁的平衡常数K=c3(CO2)/c3(CO);(3)①起始时甲容器中c3(CO2)/c3(CO)=1.03/1.03=1<64,说明该反应一定从正反应方向开始进行,反应物浓度减小,生成物浓度增大,直到达到新的平衡,设CO的平衡转化率为x,则:
2Fe(s)+3CO2(g)的△H =①的焓变-②的焓变×3=△H1 -3△H2;(2)根据平衡常数的概念,由于固体物质或纯液体的浓度是常数,不能写进表达式,则高炉炼铁的平衡常数K=c3(CO2)/c3(CO);(3)①起始时甲容器中c3(CO2)/c3(CO)=1.03/1.03=1<64,说明该反应一定从正反应方向开始进行,反应物浓度减小,生成物浓度增大,直到达到新的平衡,设CO的平衡转化率为x,则:
Fe2O3(s) + 3CO(g)  2Fe(s) + 3CO2(g)
2Fe(s) + 3CO2(g)
起始浓度/ mol·L-1 0.5 0.5
变化浓度/ mol·L-1 0.5x 0.5x
平衡浓度/ mol·L-1 0.5-0.5x 0.5+0.5x
K=c3(CO2)/c3(CO)="(" 0.5+0.5x) 3/(0.5-0.5x)3=64
( 1+x) 3/(1-x)3=64,则( 1+x)/(1-x)=4,1+x=4-4x,5x=3,x=0.6或60%
②正反应是气态物质体积保持不变的反应,则反应前后气态物质的物质的量保持不变,则平衡前后气体的压强不变,故A错误;混合气体的密度=混合气体的总质量/容器的容积,由于反应物和生成物中都有固体物质参加,且平衡前混合气体的总质量会增大,只有平衡时混合气体的总质量才保持不变,密度才不变,故B正确;正反应是气态物质体积保持不变的反应,增大CO浓度必然同时增大压强,增大压强时该平衡不能移动,CO的转化率不变,故C错误;氧化铁的固体,其浓度是常数,增加氧化铁的量不能增大反应物浓度或压强,平衡不会移动,则CO的转化率不变,故D错误;(4)根据控制变量设计探究实验方案的原理可知,实验①和②探究的目的是反应物配比对纳米MgO产率的影响,实验②和④探究的目的是温度对纳米MgO产率的影响,实验②和③探究的目的是反应时间对纳米MgO产率的影响;读图可知,在378~398K,生成的纳米MgO的粒径大小无明显变化,或者在378K~398K(或在实验温度下),随温度的升高,产率增大,383K较低温度下有利于形成较小的颗粒。
考点:考查化学反应原理大题,涉及盖斯定律的应用、化学平衡常数及应用、平衡转化率的计算、化学平衡移动、设计几种因素影响产率的探究实验、解释化学平衡图像等知识。

工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。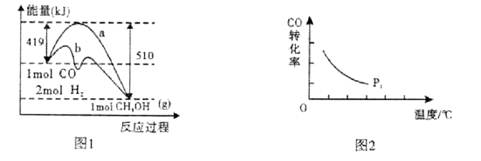
请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
| 实验组 | T/℃ | 起始浓度/mol?L-1 | 等质量催化剂的 比表面积/m2?g-1 | |
| CO | H2 | |||
| ① | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 350 | | | 124 |
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2> p1)的曲线。
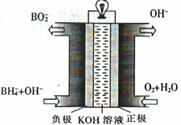
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。
反应3X(g)+Y(g) 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
| A.υ(X)=0.05mol·L—1·min—1 | B.υ(Y)= 0.10mol·L—1·min—1 |
| C.υ(Z)=0.10mol·L—1·min—1 | D.υ(W)=0.05mol·L—1·s—1 |
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H =" +" 74.9 kJ·mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
 2NH3 (g) ΔH ="c" kJ? mol-1
2NH3 (g) ΔH ="c" kJ? mol-1
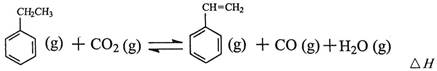
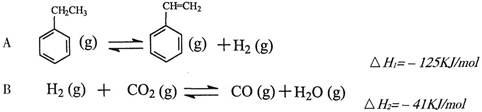
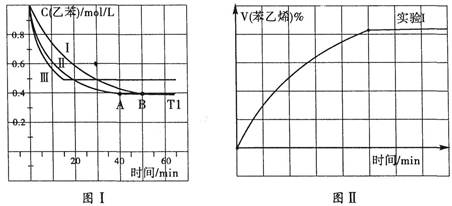
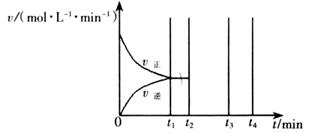
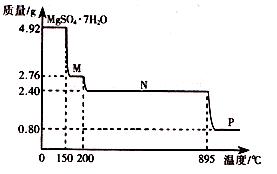
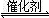 2CO2(g)+S(l) △H
2CO2(g)+S(l) △H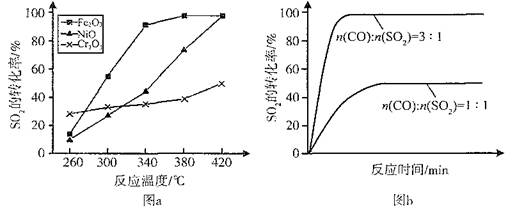
 HSO3—的平衡常数K="8.0" × 106 L?mol-1,计算时SO2、H2SO3的浓度忽略不计)
HSO3—的平衡常数K="8.0" × 106 L?mol-1,计算时SO2、H2SO3的浓度忽略不计)