题目内容
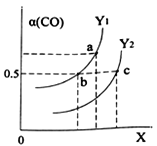
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间生成nmol的A2同时生成nmol的AB
B.容器内的压强不随时间变化
C.单位时间生成2nmol的AB同时生成nmol的B2
D.单位时间生成nmol的A2同时生成nmol的B2
【答案】C
【解析】
A. A2是反应物,AB是生成物,若反应达到平衡,则存在单位时间内生成n molA2同时生成2n molAB,A错误;
B. 该反应是反应前后气体分子数不变的反应,无论反应是否达到平衡,容器内的总压强不变,B错误;
C. B2是反应物,AB是生成物,单位时间内生成2n molAB的同时必然消耗n molB2,若生成n molB2,则相同时间内B2的消耗物质的量与产生的物质的量相等,物质的浓度不变,因此反应达到平衡,C正确;
D.A2、B2都是反应物,系数相同,因此在任何时刻都存在:单位时间内生成n molA2的同时生成n molB2,不能作为判断平衡的标准,D错误。
答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2 (亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目:___。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+ 而中毒,可服用维生素C 解毒。下列分析错误的是__(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是___(填序号)。
A.焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___。