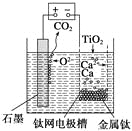
题目内容
【题目】硫有多种化合物,许多含硫化合物在工业上有重要的用途。
(1)硫化钠(Na2S)俗称硫化碱,常用于印染及制药工业。将硫化钠溶于水,会导致水的电离程度____(该“增大”、“减小”威“不变”);若微热该溶液,pH会___(填“增大”、“减小”或“不变”)。
(2)硫氢化钠(NaHS)常用作有机合成的中间体,其水溶液呈碱性。NaHS溶液中Na+、H+、HS-,OH-离子浓度由大到小的顺序为____。
(3)若向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,可发生以下反应:
Na2S+Na2SO3+H2SO4→Na2SO4+S↓+H2O(未配平)
①配平化学方程式:__Na2S+__Na2SO3+__H2SO4=__Na2SO4+__S↓+__H2O
②反应中还原产物与氧化产物的物质的量之比是__
(4)室温时,已知H2S的Ka1=1×10-7,Ka2=1×10-13,若只考虑S2-的第一步水解,则 0.1 mol·L-1Na2S溶液pH约__
(5)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为:Cu2+(aq)+FeS(s)![]() CuS(s)+Fe2+(aq)。下列有关叙述中正确的是___
CuS(s)+Fe2+(aq)。下列有关叙述中正确的是___
a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数![]()
【答案】增大; 增大; c(Na+)>c(OH)>c(HS)>c(S2)>c(H+); 2; 1; 3; 3; 3; 3; 1:2; 13; cd;
【解析】
(1)硫化钠属于强碱弱酸盐;
(2)硫离子存在两步水解,第一步水解程度远远大于第二步水解,钠离子不水解,且两步水解都生成氢氧根离子;
(3)反应中硫化钠中2价硫升高为单质硫中0价,亚硫酸钠中+4价的硫化合价降为单质硫中的0价,根据得失电子守恒配平方程式,同时方程式中氧化产物和还原产物都是S;
(4)根据KW=Ka![]() Kh,来计算硫化钠的第一部水解平衡常数;
Kh,来计算硫化钠的第一部水解平衡常数;
(5)根据沉淀转化方程式求出Ksp的大小,对于AB型的沉淀来说,沉淀溶解平衡的化学平衡常数等于沉淀的Ksp之比;
(1)硫化钠为强碱弱酸盐,在水溶液中硫离子水解生成硫氢根离子和氢氧根离子,促进水的电离,溶液显碱性,pH增大;
(2)硫离子存在两步水解,第一步水解程度远远大于第二步水解,钠离子不水解,且两步水解都生成氢氧根离子,所以离子浓度大小顺序是c(Na+)>c(OH)>c(HS)>c(S2)>c(H+);
(3)①反应中硫化钠中2价硫升高为单质硫中0价,亚硫酸钠中+4价的硫化合价降为单质硫中的0价,要使得失电子守恒,则硫化钠系数为2,亚硫酸钠系数为1,依据原子个数、电荷守恒规律,方程式:2Na2S+1Na2SO3+3H2SO4=3Na2SO4+3S↓+3H2O,反应中还原产物与氧化产物都是S,二者的物质的量之比是1:2;
(4)S2-+H2O![]() HS-+OH-,根据KW=Ka
HS-+OH-,根据KW=Ka![]() Kh,所以得出硫化钠的第一步水解平衡常数为
Kh,所以得出硫化钠的第一步水解平衡常数为![]() ,因为硫离子水解出一个氢氧根的同时,也会水解出一个硫氢根,所以假设硫氢根的浓度等于氢氧根浓度,带入硫酸钠的第一步水解平衡常数计算:Kh=
,因为硫离子水解出一个氢氧根的同时,也会水解出一个硫氢根,所以假设硫氢根的浓度等于氢氧根浓度,带入硫酸钠的第一步水解平衡常数计算:Kh=![]() ,所以C(OH-)=10-1mol/L,所以PH等于13;
,所以C(OH-)=10-1mol/L,所以PH等于13;
(5)a.根据沉淀转化方程式得出,硫化亚铁的沉淀可以转化生成硫化铜,所以硫化亚铁的沉淀溶解平衡常数小于硫化铜的沉淀溶液平衡常数,所以Ksp(FeS)>Ksp(CuS),a项正确;
b.该反应的化学平衡常数为![]() ,说明达到平衡时c(Fe2+)
,说明达到平衡时c(Fe2+)![]() c(Cu2+),b项错误;
c(Cu2+),b项错误;
c.溶液中加入少量Na2S固体后,硫离子的浓度增加,溶液中亚铁离子和铜离子都会生成沉淀,所以c(Fe2+)、c(Cu2+)都减小,c项正确;
d.该反应平衡常数![]() ,d项正确;
,d项正确;
答案选cd。

 阅读快车系列答案
阅读快车系列答案【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。

步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。
分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05 g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79 g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95 g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是___。
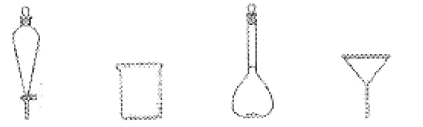
(2)步骤2中,图中所示装置中仪器A的名称是___,其作用为___。
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是___;分离有机相的操作名称为__,分离有机相时不需要用到下列玻璃仪器中的__ (填名称)。
(4)实验中可能生成的有机副产物结构简式为____ (填一种即可)。
(5)本实验中丙烯酸甲酯的产率为___%。实际产率低于理论值的原因有多种,下列所述原因中不可能的是___ (填字母)。
a.分水器收集的水里含丙烯酸甲酯 b.本实验条件下发生了副反应
c.产品在洗涤、蒸发过程中有损失 d.产品精制时收集部分低沸点物质
(6)本实验中需要采取的安全防护措施有____。