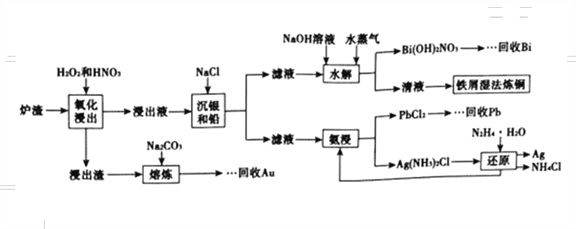
题目内容
【题目】减少CO2的排放以及CO2的资源化利用具有重要意义。
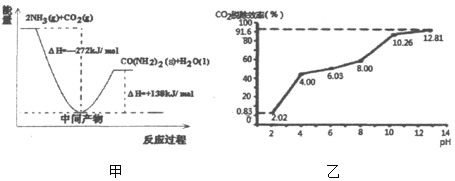
(1)H2NCOONH4是工业合成尿素[CO(NH2)2]的中间产物,该反应的能量变化示意图如图甲所示,用CO2和氨气合成尿素的热化学方程式为_____。
(2)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一。
①写出氨水捕集烟气中的CO2生成碳酸氢铵的主要化学方程式_____。
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图乙所示,烟气中CO2的含量为12%,烟气通入氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为_____(精确到0.01)。
③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是_____。
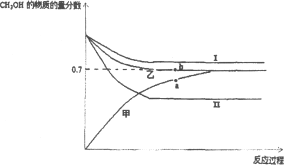
(3)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为2H2(g)+CO(g)CH3OH(g)△H=﹣90kJ/mol.在T1℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应过程如下图所示。
容器 | 甲 | 乙 | 丙 |
起始反应物投入量 | 2molH2、1molCO | 1molCH3OH | 2mol CH3OH |
①能代表丙反应的曲线是_____(选填I、II),a、b点的压强关系为Pa_____Pb(填>、<、=),理由是_____。
②b点时反应吸收的能量为_____kJ。
【答案】CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)△H=﹣134kJ/mol CO2+NH3·H2O=NH4HCO3 0.13mol 碳酸氢铵受热易分解生成CO2 I > 平衡时a点甲醇的物质的量分数小,则总物质的量大 11.25
【解析】
(1)由图可知放热为(272kJ﹣138kJ)=134kJ,则CO2和氨气合成尿素的热化学方程式为CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol;(2)①氨水捕集烟气中的CO2生成碳酸氢铵,化学方程式为CO2+NH3·H2O=NH4HCO3;②由图可知,pH为12.81的氨水吸收烟气时脱除的CO2的效率为91.6%,设脱除的CO2的物质的量最多为x,由CO2+NH3·H2O=NH4HCO3可知,![]() ,解得x=0.13mol;③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成CO2;(3)①由表格数据可知,均极限转化为甲醇时,甲、乙中起始量相同,丙中最大,且图中曲线I平衡时甲醇含量大,则能代表丙反应的曲线是I;物质的量越大、压强越大,2H2(g)+CO(g)CH3OH(g)为气体体积减小的反应,a点甲醇的物质的量分数小,则总物质的量大,即Pa>Pb;②b点时甲醇物质的量分数为0.7,则
,解得x=0.13mol;③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成CO2;(3)①由表格数据可知,均极限转化为甲醇时,甲、乙中起始量相同,丙中最大,且图中曲线I平衡时甲醇含量大,则能代表丙反应的曲线是I;物质的量越大、压强越大,2H2(g)+CO(g)CH3OH(g)为气体体积减小的反应,a点甲醇的物质的量分数小,则总物质的量大,即Pa>Pb;②b点时甲醇物质的量分数为0.7,则
CH3OH(g)2H2(g)+CO(g)△H=+90kJ/mol
起始量(mol) 1 0 0
转化量(mol) x 2x x
平衡量(mol) 1﹣x 2x x
![]() ,解得x=1/8mol,可知b点时反应吸收的能量为1/8mol×90kJ/mol=11.25kJ。
,解得x=1/8mol,可知b点时反应吸收的能量为1/8mol×90kJ/mol=11.25kJ。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组利用废旧聚乳酸材料制备乳酸铝,方案如下:
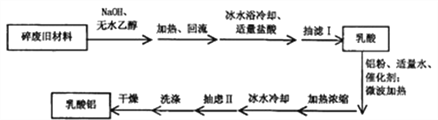
己知:①反应原理:
乳酸常温下为易溶于水、乙醇等溶剂的液体;乳酸铝为白色或黄色粉末状固体,溶于水,不溶于乙醇等有机溶剂。
请回答:
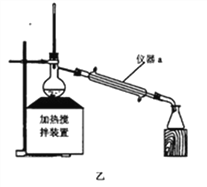
(1)聚乳酸与NaOH加热回流合适的装置是_________,仪器a的名称_________。

(2)其他条件不变调整乳酸溶液质量分数,以及其他条件不变调整乳酸和铝的物质的最之比,得出如下实验数据。根据实验1-3,最合适的(乳酸)为_________。根据实验4-6,n(乳酸):n(铝)最合适的选择为3.025,不考虑实验原料价格,最可能的理由是:_________。
编号 | 时间/h | n(乳酸)∶n(铝) | (乳酸) | 产率(%) | 编号 | 时间/h | n(乳酸)∶n(铝) | (乳酸) | 产率(%) |
1 | 8 | 3.025 | 0.10 | 64.0 | 4 | 10 | 2.935 | 0.20 | 78.4 |
2 | 8 | 3.025 | 0.20 | 72.0 | 5 | 10 | 3.025 | 0.20 | 90.2 |
3 | 8 | 3.025 | 0.30 | 68.5 | 6 | 10 | 3.505 | 0.20 | 91.3 |
(3)抽滤I需对反应容器进行洗涤,并将洗涤液也抽滤。抽虑Ⅱ需对粗产品进行洗涤。所用洗涤剂最合适的分别是_________。
A.抽滤I洗涤剂用热水,抽虑Ⅱ洗涤剂用冷水;
B.抽滤I洗涤剂用滤液,抽虑Ⅱ洗涤剂用滤液;
C.抽滤I洗涤剂先用滤液再用无水乙醇,抽虑Ⅱ洗涤剂用无水乙醇;
D.抽滤I洗涤剂先用无水乙醇再用滤液,抽虑Ⅱ洗涤剂先用无水乙醇再用滤液。
(4)乳酸铝纯度测定方法如下:取ag乳酸铝(相对分子质量294)样品溶解,加入缓冲溶液调节pH值,加入bmLcmol·L-1的EDTA溶液。然后加入指示剂,用d mol·L-1的标准锌溶液滴定过量的EDTA溶液。Al3+和Zn2+与EDTA均1∶1反应。实验消耗标准锌溶液 emL,则乳酸铝纯度为_________。