题目内容
【题目】无论以何种比例混合的10mL混和气,在50mL的氧气中燃烧生成CO2和液态的H2O,燃烧后所得气体的体积为35mL,则该混合物可能为
A. C3H6 C4H6 B. C2H6 C3H6
C. C2H4 C3H8 D. C2H2 C2H6
【答案】B
【解析】
气态烃类物质碳原子个数一般小于4,令烃的分子式为CxHy,写出其燃烧方程式,利用反应前后的体积差计算分析、判断。
因为气态烃的碳原子个数一般小于,假设烃分子式为CxHy,烃在氧气中燃烧生成CO2和液态的H2O,说明烃完全燃烧,或恰好反应,或氧气过量。用体积差计算。
CxHy+(x+y/4)O2![]() xCO2+ y/2H2O 气体体积减小△V
xCO2+ y/2H2O 气体体积减小△V
1 x+y/4 x 1+y/4
10mL (10+50)mL-35mL=25mL
10mL:25mL=1:(1+y/4),解得y=6 。由于x+y/4<5,所以x<3.5,因此只能是x=2或x=3。故为乙烷或丙烯,选项B符合题意。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】减少CO2的排放以及CO2的资源化利用具有重要意义。
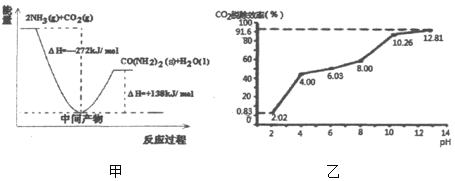
(1)H2NCOONH4是工业合成尿素[CO(NH2)2]的中间产物,该反应的能量变化示意图如图甲所示,用CO2和氨气合成尿素的热化学方程式为_____。
(2)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一。
①写出氨水捕集烟气中的CO2生成碳酸氢铵的主要化学方程式_____。
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图乙所示,烟气中CO2的含量为12%,烟气通入氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为_____(精确到0.01)。
③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是_____。
(3)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为2H2(g)+CO(g)CH3OH(g)△H=﹣90kJ/mol.在T1℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应过程如下图所示。
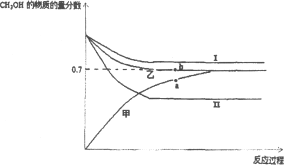
容器 | 甲 | 乙 | 丙 |
起始反应物投入量 | 2molH2、1molCO | 1molCH3OH | 2mol CH3OH |
①能代表丙反应的曲线是_____(选填I、II),a、b点的压强关系为Pa_____Pb(填>、<、=),理由是_____。
②b点时反应吸收的能量为_____kJ。