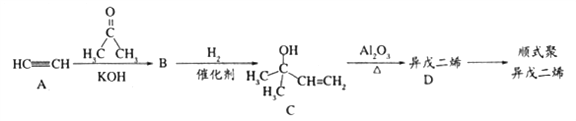
��Ŀ����
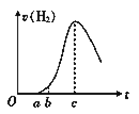
����Ŀ��ұ��¯������Ҫ�ɷ�ΪCuO��Cu��Ag��Bi��Pb��������������SiO2��Au����¯���л����м۽�����һ�ֹ���������ͼ��ʾ��
�ش��������⣺
��1��������ȡʱ����H2O2��Ŀ����__________________________(ֻҪ�ش��һ�㼴��)��
��2������ʱ����Na2CO3��Ŀ���dz��裬�ù��̵Ļ�ѧ����ʽ��_____________________________��
��3������NaOH��Һ��Ŀ���ǵ�����Һ��pH��ˮ��ʱͨ��ˮ������Ŀ����_______________________��
��4�������м���N2H4��H2O��ԭ�õ����Ļ�ѧ����ʽ��_____________________________��
��5��������Ǧʱ����֪Ksp(AgCl)=1.8��10-10,Ksp(PbCl2)=1.8��10-5����AgCl��PbCl2������c(Pb2+)��c(Ag+)=107ʱ,��Һ�е�c(Cl-)=________mol��L-1��
��6���������еõ���Ǧ��ȡPb(NO3)2����ʯī���缫�����Pb(NO3)2��Cu(NO3)2�Ļ����Һ��ȡPbO2�����������ĵ缫��Ӧʽ��_______________________�������Һ�в�����Cu(NO3)2��������Ӧʽ��______________________������������Ҫȱ����____________________________________��
���𰸡����ٵ����������ŷţ��������������� SiO2+Na2CO3![]() Na2SiO3+CO2�� ϡ����Һ������¶�ʹˮ��ƽ�������ƶ� 4Ag(NH3)2Cl+N2H4��H2O=4Ag+4NH4Cl+N2��+H2O+4NH3 0.01mol��L-1 Pb2+-2e-+2H2O=PbO2+4H+ Pb2++2e-=Pb ����Pb2+��������
Na2SiO3+CO2�� ϡ����Һ������¶�ʹˮ��ƽ�������ƶ� 4Ag(NH3)2Cl+N2H4��H2O=4Ag+4NH4Cl+N2��+H2O+4NH3 0.01mol��L-1 Pb2+-2e-+2H2O=PbO2+4H+ Pb2++2e-=Pb ����Pb2+��������
��������
���⿼�黯ѧ�������̣���1������������Ҫ��Ӧ���ܽ�Cu��Ag��Bi��Pb�����ܽ�ͭ�����ӷ�ӦCu��H2O2��2HNO3=Cu(NO3)2��2H2O����ֻ��HNO3������3Cu��8HNO3=3Cu(NO3)2��2NO����4H2O����������������Ի�����Σ������˼���H2O2��Ŀ���Ǽ��ٵ����������ŷţ��������������ʣ���2����ΪSiO2��Au�������Ӧ���Ƴ��������ijɷ���SiO2��Au������Na2CO3������SiO2+Na2CO3![]() Na2SiO3+CO2������3���˲�����ˮ�⣬ˮ����������Һ������ϡ����Һ��ͬʱˮ�������ȷ�Ӧ��ͨ��ˮ������ˮ�����¶ȸߣ��ٽ�ˮ��ƽ��������Ӧ������У���4���������̣�����Ag(NH3)2Cl��N2H4��H2O��Ag����NH4Cl����ԭ���������һ�����ʽ��백�����裬˵����ԭ�л�����NH3����Ag(NH3)2Cl��N2H4��H2O��Ag����NH4Cl��NH3��AgԪ�صĻ��ϼ۽��ͣ�N2H4��N�Ļ��ϼ�Ϊ��2�ۣ�������ԭ��Ӧ���л��ϼ۽��ͣ���Ȼ�л��ϼ۵����ߣ���N2H4��Nת��N2�����ݻ��ϼ۵�����������ƽ���ó���Ӧ����ʽΪ4Ag(NH3)2Cl+N2H4��H2O=4Ag+4NH4Cl+N2��+H2O+4NH3 ����5������Һ��c(Cl��)=xmol��L��1����Һ��c(Ag��)=Ksp/c(Cl��)=1.8��10��10/xmol��L��1����Һ��c(Pb2��)=Ksp/c2(Cl��)=1.8��10��5/x2mol��L��1��c(Pb2��)/c(Ag��)=107�����x=0.01mol��L��1����6�����ݵ��ԭ���������Ϸ���������Ӧ�����ϼ����ߣ�Pb2���������Ϸŵ磬����PbO2���缫��ӦʽΪPb2����2H2O��2e��=PbO2��4H�������ݵ��ԭ����Pb2��Ӧ�������Ϸŵ磬�缫��ӦʽΪPb2����2e��=Pb��ʵ���Ŀ�����Ʊ�PbO2����˲�����Cu(NO3)2��Һ�����Pb2���������ʽ��͡�
Na2SiO3+CO2������3���˲�����ˮ�⣬ˮ����������Һ������ϡ����Һ��ͬʱˮ�������ȷ�Ӧ��ͨ��ˮ������ˮ�����¶ȸߣ��ٽ�ˮ��ƽ��������Ӧ������У���4���������̣�����Ag(NH3)2Cl��N2H4��H2O��Ag����NH4Cl����ԭ���������һ�����ʽ��백�����裬˵����ԭ�л�����NH3����Ag(NH3)2Cl��N2H4��H2O��Ag����NH4Cl��NH3��AgԪ�صĻ��ϼ۽��ͣ�N2H4��N�Ļ��ϼ�Ϊ��2�ۣ�������ԭ��Ӧ���л��ϼ۽��ͣ���Ȼ�л��ϼ۵����ߣ���N2H4��Nת��N2�����ݻ��ϼ۵�����������ƽ���ó���Ӧ����ʽΪ4Ag(NH3)2Cl+N2H4��H2O=4Ag+4NH4Cl+N2��+H2O+4NH3 ����5������Һ��c(Cl��)=xmol��L��1����Һ��c(Ag��)=Ksp/c(Cl��)=1.8��10��10/xmol��L��1����Һ��c(Pb2��)=Ksp/c2(Cl��)=1.8��10��5/x2mol��L��1��c(Pb2��)/c(Ag��)=107�����x=0.01mol��L��1����6�����ݵ��ԭ���������Ϸ���������Ӧ�����ϼ����ߣ�Pb2���������Ϸŵ磬����PbO2���缫��ӦʽΪPb2����2H2O��2e��=PbO2��4H�������ݵ��ԭ����Pb2��Ӧ�������Ϸŵ磬�缫��ӦʽΪPb2����2e��=Pb��ʵ���Ŀ�����Ʊ�PbO2����˲�����Cu(NO3)2��Һ�����Pb2���������ʽ��͡�

 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д�����Ŀ������CO2���ŷ��Լ�CO2����Դ�����þ�����Ҫ���塣
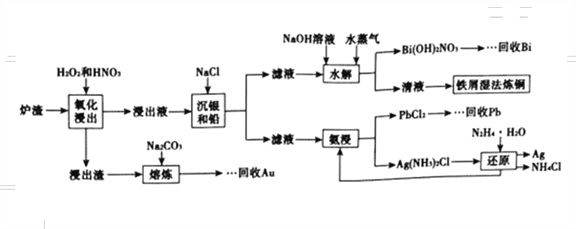
��1��H2NCOONH4�ǹ�ҵ�ϳ�����[CO��NH2��2]���м����÷�Ӧ�������仯ʾ��ͼ��ͼ����ʾ����CO2�Ͱ����ϳ����ص��Ȼ�ѧ����ʽΪ_____��
��2���ð�ˮ���������е�CO2������Σ��Ǽ���CO2�ŷŵĿ��д�ʩ֮һ��
��д����ˮ���������е�CO2����̼����淋���Ҫ��ѧ����ʽ_____��
�ڷֱ��ò�ͬpH�����ռ����������е�CO2��CO2�ѳ�Ч�������ռ���pH��ϵ��ͼ����ʾ��������CO2�ĺ���Ϊ12%������ͨ�백ˮ������Ϊ0.052m3/h����״��������pHΪ12.81�İ�ˮ��������30min���ѳ���CO2�����ʵ������Ϊ_____����ȷ��0.01����
��ͨ��������¶����ߣ�CO2�ѳ�Ч����ߣ�������40��ʱ���ѳ�CO2Ч�ʽ��͵���Ҫԭ����_____��
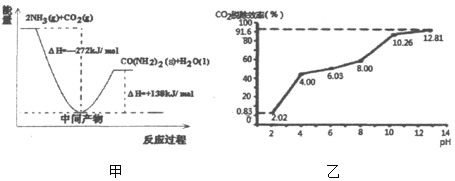
��3����CO2�ͼ��������ƺϳ�����CO��H2����CO2��Դ�����õ���Ч;�����ϳ��������Ʊ��״��ķ�ӦΪ2H2��g��+CO��g��CH3OH��g����H=��90kJ/mol����T1��ʱ���ݻ���ͬ�ļס��ҡ������������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ��������ͼ��ʾ��
���� | �� | �� | �� |
��ʼ��Ӧ��Ͷ���� | 2molH2��1molCO | 1molCH3OH | 2mol CH3OH |
���ܴ�������Ӧ��������_____��ѡ��I��II����a��b���ѹǿ��ϵΪPa_____Pb���������=����������_____��
��b��ʱ��Ӧ���յ�����Ϊ_____kJ��
����Ŀ����.���Ʊ������ǻ�ѧʵ���һ�ֳ��÷������±���ijѧϰС���о������ʵ���Ũ�ȵ�ϡ�����п��Ӧ��ʵ�����ݣ������������ݣ��ش��������⣺
��� | ��������/mL | п������/g | п����״ | �¶�/�� | ��ȫ�������ʱ��/s | ��������п������/g |
1 | 50.0 | 2.0 | ��Ƭ | 25 | 100 | m1 |
2 | 50.0 | 2.0 | ���� | 25 | 70 | m2 |
3 | 50.0 | 2.0 | ���� | 35 | 35 | m3 |
4 | 50.0 | 2.0 | ��ĩ | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | ��ĩ | 35 | 30 | m5 |
(1)��ѧ��Ӧ���ʱ���������___________________�����ģ����������Ҳ��Ӱ�췴Ӧ���ʵĴ�С����ʵ����ʵ��2��ʵ��3����________�Է�Ӧ������Ӱ�죬�����ضԷ�Ӧ���ʵľ���Ӱ���ǣ�����������ͬʱ��________________��Ӧ����Խ�졣
(2)�������ѡȡʵ��1��2��4�о�п����״�Է�Ӧ���ʵ�Ӱ�졣���Ƿ���������������ͬʱ����Ӧ����________________��Ӧ����Խ�졣
(3)��������ʵ��1��ȫ��ͬ������������Ӧ�����еμ���������ͭ��Һ�����ַ�Ӧ�������Լӿ졣ԭ����__________________________________________��
��.ij�¶�ʱ����5 L�������У�X��Y��Z������������ʵ�����ʱ��ı仯������ͼ��ʾ����ͨ������ش��������⣺
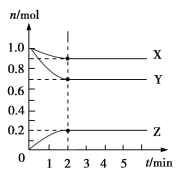
(5)��Ӧ��ʼ��2 min��Y��ƽ����Ӧ����_____________________��
(6)�����й����ݣ�д��X��Y��Z�ķ�Ӧ����ʽ______________________________��