��Ŀ����
����Ŀ������M��һ���ճ������в���ȱ�ٵĵ�ζƷ����֪C����D��ȼ�շ�����ɫ���棬M���������ʵ�ת����ϵ��ͼ��ʾ�����ֲ�������ȥ��

��1��д���ö��Ե缫���M��Һ�����ӷ���ʽ_____��
��2���Ƚ�B�и�Ԫ��ԭ�Ӱ뾶�ɴ�С_____����Ԫ�ط��ţ���
��3����A��һ������������ҿ��������첣������G�Ļ�ѧʽ��_____��
��4����A��һ�ֳ����������ʣ���A��B��Һ�ܹ���Ӧ��������F��Һ��μ���E��Һ���ӱ�����������ʵ��������_____��
��5����A��һ���Σ�A��Һ��B��Һ��ϲ�����ɫ��״������˲���Ϊ����ɫ������ɺ��ɫ��E������Aת����E�����ӷ���ʽ��_____��
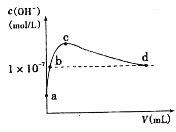
��6����A��һ����Һ��ֻ���ܺ���H+��NH4+��Mg2+��Fe3+��Al3+��CO32����SO42���е�ijЩ���ӣ��������Һ�м���B��Һʱ�������ɳ��������ʵ�����B��Һ����������仯��ͼ��ʾ���ɴ˿�֪������Һ�п϶����е����Ӽ���Ũ��֮��Ϊ_____��

��7����E�����ڼ��������ǵĴ��ڣ�д��G��Һ����������պ�IJ������Ҵ���Ӧ�Ļ�ѧ����ʽΪ_____��
���𰸡�2Cl��+2H2O![]() 2OH��+H2��+Cl2�� Na��O��H H2SiO3 ��Һ�����а�ɫ��״�������ɣ��Ҳ������ӣ�Ȼ�����ɶൽ�٣������ʧ 4Fe2++8OH��+O2+2H2O=4Fe��OH��3�� c��H+����c��Al3+����c��NH4+����c��SO42����=1��1��2��3 CH3CH2OH+CuO
2OH��+H2��+Cl2�� Na��O��H H2SiO3 ��Һ�����а�ɫ��״�������ɣ��Ҳ������ӣ�Ȼ�����ɶൽ�٣������ʧ 4Fe2++8OH��+O2+2H2O=4Fe��OH��3�� c��H+����c��Al3+����c��NH4+����c��SO42����=1��1��2��3 CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
��������
��1��C����D��ȼ�շ�����ɫ���棬Ϊ������������Ӧ����HCl������֪CΪH2��DΪCl2��FΪHCl��M���ճ������в���ȱ�ٵĵ�ζƷ����ת����ϵ��֪��M����Һ�������������������B������֪MΪNaCl��BΪNaOH���ö��Ե缫���M��Һ�����ӷ���ʽΪ2Cl��+2H2O![]() 2OH��+H2��+Cl2������2��BΪNaOH��H��O��Na�ֱ�λ��3����ͬ�����ڣ�ԭ�Ӻ�����Ӳ���Խ�࣬ԭ�Ӱ뾶Խ��ԭ�Ӱ뾶��С˳��ΪNa��O��H����3����A��һ�ֳ���������������ҿ��������첣������AΪSiO2��EΪNa2SiO3����F��Һ��Ӧ���Եõ�GΪH2SiO3����4����A��һ�ֳ����������ʣ�����NaOH��Һ�ܹ���Ӧ����AΪAl��EΪNaAlO2��������������Һ��μ���NaAlO2��Һ�У������������������������������ܽ⣬�ʿ���������Ϊ����Һ�����а�ɫ��״�������ɣ��Ҳ������ӣ�Ȼ�����ɶൽ�٣������ʧ����5����A��һ���Σ�A��Һ��B��Һ��Ͻ�������ɫ��״������˲���Ϊ����ɫ������ɺ��ɫ��E������֪A�к���Fe2+��EΪFe(OH)3��GΪFeCl3������Aת����E�����ӷ���ʽ�ǣ�4Fe2++8OH��+O2+2H2O=4Fe(OH)3������6����ͼ��֪����ʼ����NaOHû�г����������������һ����H+��һ��û��CO32���������г��������������ʧ����һ��û��Mg2+��Fe3+��һ������Al3+���м�γ������������䣬ӦΪNH4++OH��=NH3H2O�ķ�Ӧ������NH4+���ɵ���غ��֪һ������SO42����������ӦH++OH��=H2O������������NaOH��Һ�����Ϊ1�����������ӦAl3++3OH��=Al(OH)3��������������NaOH��Һ�����Ϊ3�����������ӦNH4++OH��=NH3H2O��笠�������������Ϊ2�������n��H+����n��Al3+����n��NH4+��=1��1��2���ɵ���غ��֪��n��H+����n��Al3+����n��NH4+����n��SO42����=1��1��2��3����c��H+����c��Al3+����c��NH4+����c��SO42����=1��1��2��3����7����E�����ڼ��������ǵĴ��ڣ���EΪ������ͭ��E��F����G����GΪ�Ȼ�ͭ������ͭ������ˮ�⣬�Ȼ����ӷ��������Ȼ�ͭ��Һ����������պ�IJ���Ϊ����ͭ������ͭ���Ҵ�����������ԭ��Ӧ����ͭ����ȩ����Ӧ����ʽΪCH3CH2OH+CuO
2OH��+H2��+Cl2������2��BΪNaOH��H��O��Na�ֱ�λ��3����ͬ�����ڣ�ԭ�Ӻ�����Ӳ���Խ�࣬ԭ�Ӱ뾶Խ��ԭ�Ӱ뾶��С˳��ΪNa��O��H����3����A��һ�ֳ���������������ҿ��������첣������AΪSiO2��EΪNa2SiO3����F��Һ��Ӧ���Եõ�GΪH2SiO3����4����A��һ�ֳ����������ʣ�����NaOH��Һ�ܹ���Ӧ����AΪAl��EΪNaAlO2��������������Һ��μ���NaAlO2��Һ�У������������������������������ܽ⣬�ʿ���������Ϊ����Һ�����а�ɫ��״�������ɣ��Ҳ������ӣ�Ȼ�����ɶൽ�٣������ʧ����5����A��һ���Σ�A��Һ��B��Һ��Ͻ�������ɫ��״������˲���Ϊ����ɫ������ɺ��ɫ��E������֪A�к���Fe2+��EΪFe(OH)3��GΪFeCl3������Aת����E�����ӷ���ʽ�ǣ�4Fe2++8OH��+O2+2H2O=4Fe(OH)3������6����ͼ��֪����ʼ����NaOHû�г����������������һ����H+��һ��û��CO32���������г��������������ʧ����һ��û��Mg2+��Fe3+��һ������Al3+���м�γ������������䣬ӦΪNH4++OH��=NH3H2O�ķ�Ӧ������NH4+���ɵ���غ��֪һ������SO42����������ӦH++OH��=H2O������������NaOH��Һ�����Ϊ1�����������ӦAl3++3OH��=Al(OH)3��������������NaOH��Һ�����Ϊ3�����������ӦNH4++OH��=NH3H2O��笠�������������Ϊ2�������n��H+����n��Al3+����n��NH4+��=1��1��2���ɵ���غ��֪��n��H+����n��Al3+����n��NH4+����n��SO42����=1��1��2��3����c��H+����c��Al3+����c��NH4+����c��SO42����=1��1��2��3����7����E�����ڼ��������ǵĴ��ڣ���EΪ������ͭ��E��F����G����GΪ�Ȼ�ͭ������ͭ������ˮ�⣬�Ȼ����ӷ��������Ȼ�ͭ��Һ����������պ�IJ���Ϊ����ͭ������ͭ���Ҵ�����������ԭ��Ӧ����ͭ����ȩ����Ӧ����ʽΪCH3CH2OH+CuO![]() CH3CHO+Cu+H2O��
CH3CHO+Cu+H2O��

 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�����Ŀ������CO2���ŷ��Լ�CO2����Դ�����þ�����Ҫ���塣
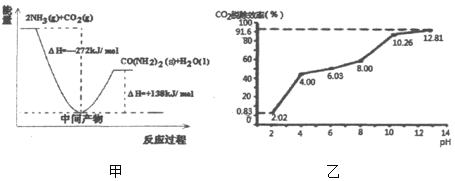
��1��H2NCOONH4�ǹ�ҵ�ϳ�����[CO��NH2��2]���м����÷�Ӧ�������仯ʾ��ͼ��ͼ����ʾ����CO2�Ͱ����ϳ����ص��Ȼ�ѧ����ʽΪ_____��
��2���ð�ˮ���������е�CO2������Σ��Ǽ���CO2�ŷŵĿ��д�ʩ֮һ��
��д����ˮ���������е�CO2����̼����淋���Ҫ��ѧ����ʽ_____��
�ڷֱ��ò�ͬpH�����ռ����������е�CO2��CO2�ѳ�Ч�������ռ���pH��ϵ��ͼ����ʾ��������CO2�ĺ���Ϊ12%������ͨ�백ˮ������Ϊ0.052m3/h����״��������pHΪ12.81�İ�ˮ��������30min���ѳ���CO2�����ʵ������Ϊ_____����ȷ��0.01����
��ͨ��������¶����ߣ�CO2�ѳ�Ч����ߣ�������40��ʱ���ѳ�CO2Ч�ʽ��͵���Ҫԭ����_____��
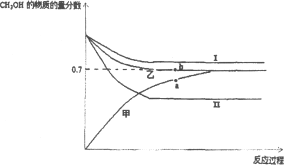
��3����CO2�ͼ��������ƺϳ�����CO��H2����CO2��Դ�����õ���Ч;�����ϳ��������Ʊ��״��ķ�ӦΪ2H2��g��+CO��g��CH3OH��g����H=��90kJ/mol����T1��ʱ���ݻ���ͬ�ļס��ҡ������������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ��������ͼ��ʾ��
���� | �� | �� | �� |
��ʼ��Ӧ��Ͷ���� | 2molH2��1molCO | 1molCH3OH | 2mol CH3OH |
���ܴ�������Ӧ��������_____��ѡ��I��II����a��b���ѹǿ��ϵΪPa_____Pb���������=����������_____��
��b��ʱ��Ӧ���յ�����Ϊ_____kJ��