题目内容
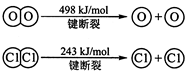
I.已知:反应①H2(g) + Cl2(g) = 2HCl(g) ΔH=" —184" kJ/mol
②4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ΔH=" —115.6" kJ/mol
2Cl2(g)+2H2O(g) ΔH=" —115.6" kJ/mol 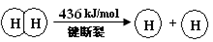
请回答:
(1)H2与O2反应生成气态水的热化学方程式
(2)断开1 mol H—O 键所需能量约为 kJ。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 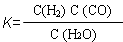 ,它所对应的化学方程式为: 。
,它所对应的化学方程式为: 。
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g)  2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol·L-1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
Ⅰ (1)2H2(g) + O2(g)= 2H2O(g) ΔH=" —483.6" kJ/mol (2)463.4
Ⅱ (1)C(s)+H2O(g) H2(g) + CO(g) (2) = A (3) ① > ② C
H2(g) + CO(g) (2) = A (3) ① > ② C
解析试题分析:Ⅰ(1)①×2+②得:2H2(g) + O2(g)= 2H2O(g) ΔH=" —483.6" kJ/mol;2×436KJ/mol+1mo498KJ/mol-4×XKJ/mol="—483.6" kJ/mol 解得X=463.4KJ/mol。
II.根据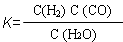 可得反应方程式:H2O(g)+C(s)
可得反应方程式:H2O(g)+C(s) H2(g)+CO(g). (2)已知在400℃时,N2(g)+ 3H2(g)
H2(g)+CO(g). (2)已知在400℃时,N2(g)+ 3H2(g)  2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,各物质的浓度是C(N2)=4mol/L;C(H2)=2mol/L;C(NH3)=4mol/L此时则此时C2(NH3)/{ C(N2)·C3(H2)}=42/(4×23)="1/8=0.5" = K,反应V(N2)正=V(N2)逆.该反应的正反应是一个气体体积减小的放热反应。A.增大压强,由于反应混合物个物质的浓度都增大所以速率加快,并且平衡向气体体积减小的方向移动,也就是向正反应方向移动。正确。B升高温度,化学反应速率加快,但是升高温度化学平衡向吸热反应方向即逆反应方向移动。错误。C加入催化剂,反应速率大大加快,但催化剂不能使化学平衡发生移动。错误。D.使氨气液化移走,平衡正向移动,但由于生成物的浓度减小,所以反应速率减慢。错误。所以欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,即反应速率加快而且平衡向正反应方向移动。可采取的正确措施是A.缩小体积增大压强。(3)①根据常数K与温度t的关系可知升高温度。K增大说明升高温度化学平衡向正反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。该反应的正反应是吸热反应。所以ΔH>0. ②A.当可能反应达到平衡时任何物质的消耗速率和产生速率应该相等。错误。B 只有当投入的A和B的物质的量的比符合方程式中的该物质的系数关系,转化率相等才能证明反应达到平衡。错误。C.该反应反应前后气体体积不等,若容器内压强保持不变,即各物质的物质的量不变,反应达到平衡。正确。D由于容器的容积不变,无论是否反应,也不管反应进行到什么程度,容器内物质的质量不变。所以任何时刻,无论反应是否达到平衡,混合气体的密度都不会发生变化。错误。
2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,各物质的浓度是C(N2)=4mol/L;C(H2)=2mol/L;C(NH3)=4mol/L此时则此时C2(NH3)/{ C(N2)·C3(H2)}=42/(4×23)="1/8=0.5" = K,反应V(N2)正=V(N2)逆.该反应的正反应是一个气体体积减小的放热反应。A.增大压强,由于反应混合物个物质的浓度都增大所以速率加快,并且平衡向气体体积减小的方向移动,也就是向正反应方向移动。正确。B升高温度,化学反应速率加快,但是升高温度化学平衡向吸热反应方向即逆反应方向移动。错误。C加入催化剂,反应速率大大加快,但催化剂不能使化学平衡发生移动。错误。D.使氨气液化移走,平衡正向移动,但由于生成物的浓度减小,所以反应速率减慢。错误。所以欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,即反应速率加快而且平衡向正反应方向移动。可采取的正确措施是A.缩小体积增大压强。(3)①根据常数K与温度t的关系可知升高温度。K增大说明升高温度化学平衡向正反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。该反应的正反应是吸热反应。所以ΔH>0. ②A.当可能反应达到平衡时任何物质的消耗速率和产生速率应该相等。错误。B 只有当投入的A和B的物质的量的比符合方程式中的该物质的系数关系,转化率相等才能证明反应达到平衡。错误。C.该反应反应前后气体体积不等,若容器内压强保持不变,即各物质的物质的量不变,反应达到平衡。正确。D由于容器的容积不变,无论是否反应,也不管反应进行到什么程度,容器内物质的质量不变。所以任何时刻,无论反应是否达到平衡,混合气体的密度都不会发生变化。错误。
考点:考查化学键与反应热的关系、热化学方程式的书写、外界条件对化学平衡的影响和平衡状态的判断等知识。

尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。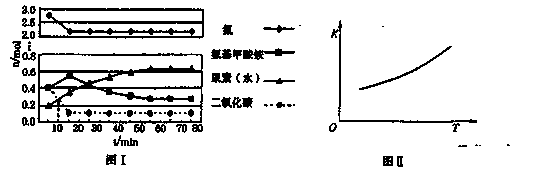
已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定, 总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/Kpa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ ? mol-1。
(4)尿素燃料电池的结构如图所示。其工作时负极电极反应式可表示为______。

氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用, 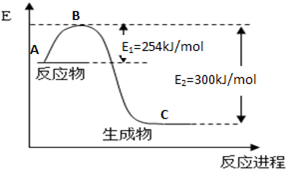
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: 。
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1。
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1 ,E2______,
△H (填“增大”、“减小”、“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g)= 2N2(g)+6H2O(g) ;△H1=akJ·mol-1
N2(g)+O2(g)=2NO(g); △H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)。
 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表: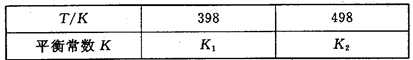
 2H2O(l) △H=-483.6 kJ/mol
2H2O(l) △H=-483.6 kJ/mol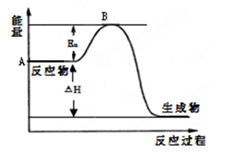
 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
 2SO3(g),写出该反应的化学平衡常数表达式:
2SO3(g),写出该反应的化学平衡常数表达式: 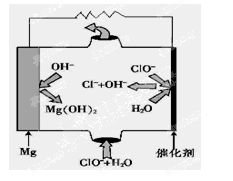
 2K2CO3+6H2O
2K2CO3+6H2O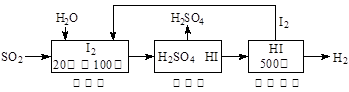
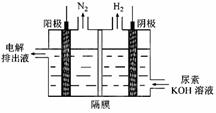
 Ni(OH)2+M
Ni(OH)2+M