题目内容
(1)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用KOH溶液作电解质溶液,多孔石墨作电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。
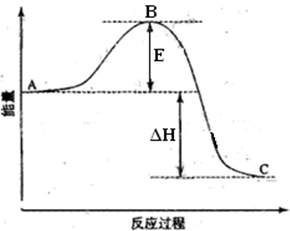
(3)在右图所示实验装置中,石墨棒上的电极反应式为 。如果起始时盛有1L pH=5的CuSO4溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。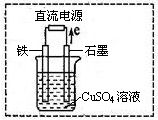
(4)将普通碳钢钉放入“84消毒液”(NaClO溶液)中浸泡一段时间。预期的实验现象是 。
(5)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,某同学设计了如图所示实验装置,写出碳(C)极上发生的电极反应式 。
(1)2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=?3116.6 kJ·mol-1(2分)
(2)负 C2H6+18OH-?14e-=2CO32-+12H2O
(3)4OH-?4e-=2H2O+O2↑(2H2O?4e-=O2↑+4H+)
石墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅氧化铜(或碳酸铜) 4g(或6.2g)
(4)钢钉表面有红褐色物质生成
(5)ClO-+H2O+2e-=Cl-+2OH-
解析 试题分析:(1)依据热化学方程式的书写原则结合定量关系写出反应为生成物、各物质的聚集状态、对应反应的焓变得到热化学方程式为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H=-3116.6 kJ/mol;
试题分析:(1)依据热化学方程式的书写原则结合定量关系写出反应为生成物、各物质的聚集状态、对应反应的焓变得到热化学方程式为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H=-3116.6 kJ/mol;
故答案为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H="-3116.6" kJ/mol;
(2)利用反应①2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H="-3116.6" kJ/mol;设计原电池,根据化合价变化分析判断,乙烷失电子发生氧化反应,所以通入乙烷气体的电极应为负极,正极电极反应为:②O2+2H2O+4e-=4OH-; ①-②×7 得到负极电极反应为:C2H6-14e-+18OH-═2CO32-+12H2O;(3)如图所示实验装置中,石墨棒上是电子流出一端,电解池中电子流出的是阳极,所以阳极电极反应为氢氧根离子放电,电极反应为:4OH--4 e-═O2↑+2H2O;惰性电极电解硫酸铜溶液生成铜、氧气、硫酸,恢复原溶液浓度需要加入析出的物质,即加入氧化铜可以恢复,故答案为:4OH--4 e-═O2↑+2H2O;CuO;将碳钢铁钉浸在次氯酸钠中,会发生电化学腐蚀。其中铁为负极,碳为正极。铁失电子,因为次氯酸根离子的强氧化性,次氯酸根离子得电子生成Cl—。故(4)钢钉表面有红褐色物质生;(5)ClO-+H2O+2e-═Cl-+2OH-
考点:考查热化学方程式、电化学原理等相关知识。

 名校课堂系列答案
名校课堂系列答案二甲醚是—种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为_______________________________________。
(2)煤的气化过程中产生的有害气体用溶液吸收,生成两种酸式盐,该反应的
化学方程式为__________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);△H=-90.8kJ·mol-1
CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g);△H=-41.3kJ·mol-1
CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= ;
CH3OCH3(g)+CO2(g)的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
________________(填字母代号)。
a.高温b.加入催化剂c.减少CO2的浓度d.增加CO的浓度e.分离出二甲醚
(4)已知反应②2CH3OH(g)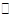 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L) | 0.44 | 0.6 | 0.6 |
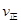 _______
_______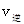 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②若加入CH3OH后,经l0min反应达到平衡,此时c(CH3OH)=__________;该时
间内反应速率v(CH3OH)=__________________。
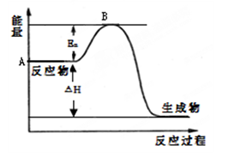
 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
 2H2O(l) △H=-483.6 kJ/mol
2H2O(l) △H=-483.6 kJ/mol 2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题: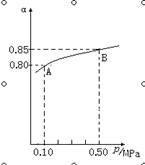
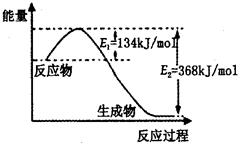
 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
 2K2CO3+6H2O
2K2CO3+6H2O