题目内容
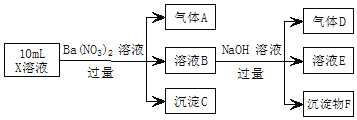
【题目】某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如图实验:已知:AgSCN为白色难溶物。下列说法不正确的是( )

A.①中的白色沉淀是![]()
B.向①的试管中滴加![]() KI溶液,有黄色沉淀生成证明存在
KI溶液,有黄色沉淀生成证明存在![]()
![]()
![]()
C.②中发生了氧化还原反应
D.对于②中红色褪去的原因可能与平衡移动原理有关
【答案】D
【解析】
A.硝酸银溶液中滴入硫酸铵,生成白色沉淀为硫酸银,化学式为Ag2SO4,故A正确;
B.向①的试管中滴加0.5mol/L KI溶液,有黄色沉淀生成,是硫酸银转化为AgI,发生的是沉淀转化,反应的离子方程式为Ag2SO4(s)+2 I-2AgI(s)+SO42-,故B正确;
C.②中硝酸银溶液中滴入硫酸亚铁铵,有白色沉淀生成是生成的硫酸银,试管壁有银析出,可能发生的离子反应是银离子氧化亚铁离子为铁离子,银离子被还原为银单质,反应的离子方程式为Ag++Fe2+=Ag+Fe3+,②发生了氧化还原反应,故C正确;
D.取上层清液,滴加KSCN溶液,产生白色沉淀,溶液局部变红色,振荡后红色褪去,沉淀量增加,若与平衡移动有关,那么局部溶液发生反3SCN-+Fe3+Fe(SCN)3,当振荡试管时,溶液中过量银离子与硫氰根反应生成白色沉淀AgSCN,降低了硫氰根离子的浓度,上述平衡逆向进行,溶液红色会变淡,但不至于消失,故D错误;
故选D。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
容器(温度) | t(min) c(molL-1) | 0 | 40 | 80 | 120 | 160 |
甲(400℃) | c(NO) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(400℃) | c(NO) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙(T℃) | c(NO) | 2.00 | 1.40 | 1.10 | 1.10 | 1.10 |
A.达到平衡状态时,2v正c(NO)=v逆c(N2)
B.容器内压强不再改变说明反应已达平衡
C.丙容器中从反应开始到建立平衡的平均反应速率v c(NO)=0.01125 mol·L-1·min-1
D.由表格数据可知:T>400