题目内容
16.下列无色透明的溶液中能大量共存的离子组是( )| A. | Cu2+、OH-、Al3+、NO3- | B. | H+、CO32-、[Al(OH)4]-、Na+ | ||
| C. | [Al(OH)4]-、OH-、Na+、Cl- | D. | Ba2+、Mg2+、NO3-、SO42- |
分析 溶液无色时可排除Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.铜离子为有色离子,铜离子、铁离子都与氢氧根离子反应;
B.氢离子与碳酸根离子、[Al(OH)4]-反应;
C.四种离子之间不发生反应,都是无色离子;
D.钡离子与硫酸根离子反应生成硫酸钡沉淀.
解答 解:无色溶液时可排除Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.Cu2+为有色离子,不满足溶液无色的条件,Cu2+、Al3+都与OH-反应,在溶液中不能大量共存,故A错误;
B.H+与CO32-、[Al(OH)4]-发生反应,在溶液中不能大量共存,故B错误;
C.[Al(OH)4]-、OH-、Na+、Cl-之间不反应,且都是无色离子,在溶液中能够大量共存,故C正确;
D.Ba2+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
7.某有机物的结构式为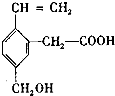 ,这种有机物不可能具有的性质是( )
,这种有机物不可能具有的性质是( )
 ,这种有机物不可能具有的性质是( )
,这种有机物不可能具有的性质是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 能发生酯化反应 | ||
| C. | 能跟NaOH溶液反应 | D. | 不能发生取代反应 |
4.下列为某同学利用所学的相关数据进行的推测,其中不正确的是( )
| A. | 根据电解质的电离程度数据推测电解质溶液的导电性 | |
| B. | 用分子所具有能量数据分析分子的稳定性 | |
| C. | 应用固体溶解度数据判断某些复分解反应能否进行 | |
| D. | 利用电解质的电离常数判断某些酸式盐的水溶液的酸碱性 |
11.1mol下列物质在足量氧气中充分燃烧,消耗氧气物质的量最多的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 乙醇 |
8.下列说法中,正确的是( )
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 其他条件相同时,增大反应物浓度,反应物中活化分子的百分数增加 | |
| C. | 焓变和熵变都与反应的自发性有关,它们都能独立地作为自发性的判据 | |
| D. | 常温下,FeCl3溶液中由水电离出的c (H+)一定大于1×10-7mol/L |
5.以下比较中,正确的是( )
| A. | 微粒半径:O2-<F-<Na+<Li+ | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 分子中的键角:CH4>H2O>CO2 | |
| D. | 共价键的键能:C-C>C-Si>Si-Si |
6.下列实验中,对应的现象以及结论都对应正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B. | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| C. | AgI沉淀中滴加稀KCl溶液 | 有白色沉淀出现 | AgCl的溶度积比AgI的小 |
| D. | 去少量无色溶液,先滴加氯水,再加入少量CCl4,振荡,静置 | 溶液分层,下层呈橙红色 | 原无色溶液中含有溴离子 |
| A. | A | B. | B | C. | C | D. | D |
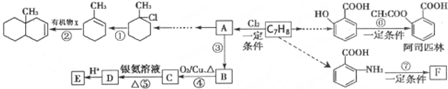

 (苯胺,易被氧化)
(苯胺,易被氧化)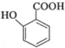 可选用的试剂有(填标号).a.FeCl3溶液 b.浓溴水 c.Na D.NaHCO3溶液
可选用的试剂有(填标号).a.FeCl3溶液 b.浓溴水 c.Na D.NaHCO3溶液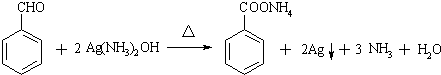 ;
; $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$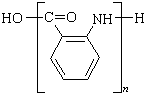 +(n-1)H2O.
+(n-1)H2O. 的合成路线流程图(无机试剂任用)
的合成路线流程图(无机试剂任用) $→_{△}^{浓硫酸、浓硝酸}$
$→_{△}^{浓硫酸、浓硝酸}$ $\stackrel{酸性高锰酸钾溶液}{→}$
$\stackrel{酸性高锰酸钾溶液}{→}$ $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$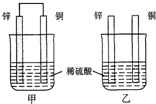 现有如下两个反应:A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O B.Zn+H2SO4═ZnSO4+H2↑
现有如下两个反应:A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O B.Zn+H2SO4═ZnSO4+H2↑