题目内容
1. 现有如下两个反应:A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O B.Zn+H2SO4═ZnSO4+H2↑
现有如下两个反应:A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O B.Zn+H2SO4═ZnSO4+H2↑(1)上述反应属于放热反应的是B(填“A”或“B”).
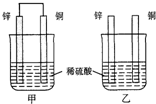
(2)将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
①在甲乙两个烧杯中,甲铜极上发生还原反应(填“氧化”或“还原”),乙在Zn表面产生气泡(填“Cu”或“Zn”).
②能构成原电池的是甲装置(填“甲”或“乙”),其中负极为Zn电极(填“Cu”或“Zn”).
③两个装置中Zn均被腐蚀,若转移0.2mol电子,理论上Zn片质量减轻6.5g.
(3)在进行上述实验时发现甲放出气泡的速率较快,为了加快乙的反应速率,可采用的措施有升高温度(写出一种即可).
分析 (1)根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱);
(2)①甲装置是原电池,铜极为正极发生还原反应,乙装置发生化学腐蚀,Zn表面产生气泡;
②甲装置是原电池,原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+;
③构成原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,据此计算;
(3)为了加快乙的反应速率,可采用的措施有升温.增加浓度等.
解答 解:(1)A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O 是吸热反应,故错误;
B.Zn+H2SO4═ZnSO4+H2↑为放热反应,故正确;故选:B;
(2)①甲装置是原电池,铜极为正极发生还原反应,乙装置发生化学腐蚀,Zn表面产生气泡,故答案为:还原;Zn;
②甲装置是原电池,原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,故答案为:甲;Zn;
③构成原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,所以若转移0.2mol电子,理论上Zn片质量减轻$\frac{0.2}{2}$×65g=6.5g,故答案为:6.5;
(3)为了加快乙的反应速率,可采用的措施有升温.增加浓度等,故答案为:升高温度.
点评 本题考查学生原电池的构成条件以及工作原理知识,属于综合知识的考查,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
11.烷烃的结构和性质具有很多相似性,据此有关乙烷的说法正确的是( )
| A. | 常温下是气体,易溶于水 | |
| B. | 甲烷的一氯取代物有一种,乙烷的一氯取代物有2种 | |
| C. | 在光照条件下能与Cl2发生取代反应 | |
| D. | 在空气中不能点燃 |
12.下列物质属于同系物的是( )
| A. | CH3COOH与HCOOCH3 | |
| B. |  -OH与 -OH与 -CH2OH -CH2OH | |
| C. | CH3CH2CH2OH与CH${\;}_{{3}_{\;}}$CH2CH2CH2OH | |
| D. | CH3CH2CH2Br与CH3CH2CH2CH2Cl |
9.下列物质可以用来除去乙烷中混有的乙烯的是( )
| A. | NaOH溶液 | B. | 溴水 | C. | CCl4 | D. | H2 |
16.下列无色透明的溶液中能大量共存的离子组是( )
| A. | Cu2+、OH-、Al3+、NO3- | B. | H+、CO32-、[Al(OH)4]-、Na+ | ||
| C. | [Al(OH)4]-、OH-、Na+、Cl- | D. | Ba2+、Mg2+、NO3-、SO42- |
6.下列电池工作时能量转化形式与其它三个不同的是( )
| A. |  硅太阳能电池 | B. |  锌锰碱性电池 | C. |  氢燃料电池 | D. |  铅蓄电池 |
13.已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,下列说法不正确的是( )
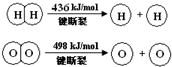

| A. | 该反应原理可用于设计氢氧燃料电池 | |
| B. | 破坏1 mol H-O键需要的能量是463.4 kJ | |
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8 kJ/mol | |
| D. | H2(g)中的H-H键能比H2O(g)中的H-O键能大 |
10.有机化合物A(C8H8O2)为一种无色液体,从A出发可发生如图的一系列反应.则下列说法正确的是( )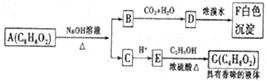

| A. | A的结构中含有碳碳双键 | |
| B. | G的同分异构体中属于酯且能发生银镜反应的只有一种 | |
| C. | 上述各物质中能发生水解反应的有A、B、D、G | |
| D. | 根据图示可推知D为苯酚 |