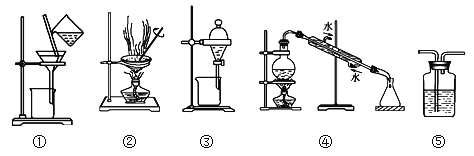
题目内容
【题目】现有A、B、C、D、E、F六种位于周期表前四周期的元素,其原子序数依次增大,相关信息如下表所示:
元素 | 性质 |
A | 一种核素的原子核内不含中子 |
B | 原子核外电子有6种不同运动状态 |
C | 最高价氧化物的水化物与其氢化物可生成盐 |
D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
E | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
F | 该元素的一种氧化物可用作油漆颜料,与某单质反应可应用于焊接钢轨 |
根据以上信息,回答下列问题:
(1)F元素位于周期表的____区(填s、p、d、ds或f),B、C、D三种元素的第一电离能由大到小顺序为______________________(用元素符号表示)。
(2)ED2中E原子的杂化类型为__________________;ED2易溶于水的原因可能是___________(填序号)。
①ED2与水极性相同 ②ED2可以与水反应 ③ED2可以与水形成氢键
(3)F元素的一种氯化物常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断该氯化物晶体为________晶体。
(4)F的单质晶体在不同温度下有两种堆积方式(晶胞结构如图所示),面心立方晶胞和体心立方晶胞中实际含有的F原子个数之比为________,其中体心立方晶胞空间利用率为___________(设F原子半径是r,列出含r的计算表达式,不需化简)。

【答案】 d N>O>C sp2杂化 ①② 分子 2∶1 ![]()
【解析】一种核素的原子核内不含中子的元素A,则A为氢元素;原子核外电子有6种不同运动状态,则核电荷数为6,元素B为碳元素;最高价氧化物的水化物与其氢化物可生成盐硝酸铵,则C元素为氮元素;单质之一为淡蓝色气体,可阻挡对人体有害的紫外线,则D元素为氧元素;周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍,故其原子核外电子排布为1s22s22p63s23p4,则E为S元素;F元素的一种氧化物可用作油漆颜料,与某单质反应可应用于焊接钢轨,则F为铁元素。(1) F元素为铁元素,位于周期表的d区,B为碳元素,C为氮元素,D为氧元素,同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由小到大的顺序为N>O>C ;(2) (3)SO2中S原子的价层电子对数=2+![]() =3,S原子采取sp2杂化,S原子有1对孤电子对,分子空间构型为V形,SO2是极性分子,H2O是极性分子,根据相似相容原理可知由极性分子组成的溶质容易溶解于极性分子组成的溶剂中,此外SO2会和水发生反应SO2+H2O=H2SO3,反应不断消耗SO2也使它不断的溶解,因此SO2易溶于水,答案选①②;(3) F元素的一种氯化物常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,符合分子晶体的特征,故为分子晶体;(4) 由晶胞结构可知,面心立方晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12;体心立方晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,故面心立方、体心立方两种晶胞中铁原子的配位数之比为12:6=2:1;在体心立方堆积的晶胞中,体对角线上的三个原子相切,体对角线长度等于原子半径的4倍。假定晶胞边长为a ,则a2 + 2a2 = (4r)2, a=
=3,S原子采取sp2杂化,S原子有1对孤电子对,分子空间构型为V形,SO2是极性分子,H2O是极性分子,根据相似相容原理可知由极性分子组成的溶质容易溶解于极性分子组成的溶剂中,此外SO2会和水发生反应SO2+H2O=H2SO3,反应不断消耗SO2也使它不断的溶解,因此SO2易溶于水,答案选①②;(3) F元素的一种氯化物常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,符合分子晶体的特征,故为分子晶体;(4) 由晶胞结构可知,面心立方晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12;体心立方晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,故面心立方、体心立方两种晶胞中铁原子的配位数之比为12:6=2:1;在体心立方堆积的晶胞中,体对角线上的三个原子相切,体对角线长度等于原子半径的4倍。假定晶胞边长为a ,则a2 + 2a2 = (4r)2, a=![]() ,晶胞体积V晶胞 =
,晶胞体积V晶胞 =![]() 。体心堆积的晶胞上占有的原子个数为2,原子占有的体积为V原子=2×(
。体心堆积的晶胞上占有的原子个数为2,原子占有的体积为V原子=2×(![]() ) 。 晶胞的空间利用率等于
) 。 晶胞的空间利用率等于![]() =
=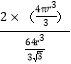 。
。

【题目】用如下图所示的装置进行实验(夹持仪器略去,必要时可加热),其中a、b、c中分别盛有试剂1、2、3,能达到相应实验目的的是
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 | 装置 |
A | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 除去Cl2中的HC1 |
|
B | 浓HNO3 | Cu片 | KI—淀粉溶液 | 验证NO2的氧化性 | |
C | 稀硫酸 | 溶液X | 澄淸石灰水 | 验证X中是否有CO32- | |
D | 70%硫酸 | Na2SO3 | 酸性KMnO4溶液 | 验证SO2具有漂白性 |
A. A B. B C. C D. D