题目内容
【题目】下列实验中,所选装置或实验设计合理的是
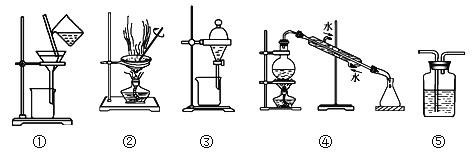
A. 用图④所示装置可以分离乙醇水溶液
B. 用乙醇提取溴水中的溴选择图③所示装置
C. 图⑤所示装置中盛有饱和![]() 溶液除去
溶液除去![]() 中含有的少量
中含有的少量![]()
D. 用图①和②所示装置可以除去![]() 中的
中的![]() 杂质,并获得
杂质,并获得![]() 固体
固体
【答案】D
【解析】
A.乙醇与水互溶,可利用乙醇和水的沸点差异采用蒸馏的方法进行分离,蒸馏时需要温度计测定馏分,图中缺少温度计,故A项错误;
B.乙醇与水互溶,不能作萃取剂,应选四氯化碳或苯等提取碘水中的碘,选择图③所示装置,故B项错误;
C.装置⑤是洗气瓶,但瓶内的溶液不能是饱和Na2CO3溶液,因为二氧化碳也能与碳酸钠溶液反应生成碳酸氢钠,应该用饱和NaHCO3溶液除去二氧化碳中混有的氯化氢,故C错误;
D.碳酸钠中混有碳酸钙杂质,可将固体溶解,再进行过滤除去碳酸钙,然后再将滤液蒸发结晶,可得到碳酸钠固体,故选择图①和②所示装置,D项正确,答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】在一定温度下、1L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示,下列有关说法正确的是
x | y | w | |
n(起始)/mol | 2 | l | 0 |
n(平衡)/mol | l | 0.5 | 1.5 |
A. 该温度下,此反应的平衡常数表达式是![]()
B. 升高温度,若w的体积分数减小,则此反应ΔH>0
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向容器中通入3molw,达到平衡时,n(x)=2mol
【题目】现有A、B、C、D、E、F六种位于周期表前四周期的元素,其原子序数依次增大,相关信息如下表所示:
元素 | 性质 |
A | 一种核素的原子核内不含中子 |
B | 原子核外电子有6种不同运动状态 |
C | 最高价氧化物的水化物与其氢化物可生成盐 |
D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
E | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
F | 该元素的一种氧化物可用作油漆颜料,与某单质反应可应用于焊接钢轨 |
根据以上信息,回答下列问题:
(1)F元素位于周期表的____区(填s、p、d、ds或f),B、C、D三种元素的第一电离能由大到小顺序为______________________(用元素符号表示)。
(2)ED2中E原子的杂化类型为__________________;ED2易溶于水的原因可能是___________(填序号)。
①ED2与水极性相同 ②ED2可以与水反应 ③ED2可以与水形成氢键
(3)F元素的一种氯化物常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断该氯化物晶体为________晶体。
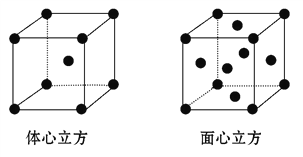
(4)F的单质晶体在不同温度下有两种堆积方式(晶胞结构如图所示),面心立方晶胞和体心立方晶胞中实际含有的F原子个数之比为________,其中体心立方晶胞空间利用率为___________(设F原子半径是r,列出含r的计算表达式,不需化简)。