题目内容
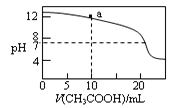
【题目】300℃时,将100mL由H2O、CO2和N2组成的混合气体通入盛有足量Na2O2的密闭容器中(容器体积保持不变),充分反应后恢复到原温度时容器内的压强变为原来的4/5,则原混合气体中N2的体积分数为
A. 33.3% B. 40% C. 60% D. 75%
【答案】C
【解析】容器内的压强变为原来的![]() ,则总体积减小原来的
,则总体积减小原来的![]() ,故反应后总体积减少为100mL×
,故反应后总体积减少为100mL×![]() =20mL,Na2O2与CO2发生反应:2CO2+2Na2O2=2Na2CO3+O2,水蒸气与过氧化钠发生反应:2H2O+2Na2O2=4NaOH+O2↑,减少的体积为生成氧气的体积,由方程式可知生成氧气体积为H2O、CO2总体积的一半,则H2O、CO2总体积为20mL×2=40mL,故原混合气体中氮气为100mL-40mL=60mL,则氮气体积分数为
=20mL,Na2O2与CO2发生反应:2CO2+2Na2O2=2Na2CO3+O2,水蒸气与过氧化钠发生反应:2H2O+2Na2O2=4NaOH+O2↑,减少的体积为生成氧气的体积,由方程式可知生成氧气体积为H2O、CO2总体积的一半,则H2O、CO2总体积为20mL×2=40mL,故原混合气体中氮气为100mL-40mL=60mL,则氮气体积分数为![]() =60%,答案选C。
=60%,答案选C。

练习册系列答案
相关题目