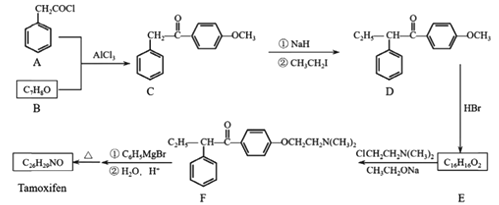
题目内容
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法错误的是
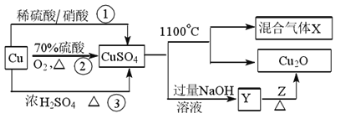
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B.Z可以是葡萄糖
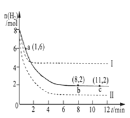
C.混合气体中一定有O2,1 mol CuSO4完全反应生成O2为0.5 mol
D.相对于途径①、③,途径②更好地体现了绿色化学思想
【答案】C
【解析】
A..如途径①用混酸,Cu与混酸反应,3Cu+3H2SO4+2HNO3(稀)=3CuSO4+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2,故A正确;
B.葡萄糖与氢氧化铜反应的方程式为C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,所以Z可为葡萄糖,故B正确;
C.根据2CuSO4![]() Cu2O+SO2↑+SO3↑+O2↑知,1molCuSO4在1100℃所得混合气体X中,O2为0.5mol,但是,由于存在三氧硫的分解平衡,无法确定产物中氧气的物质的量是多少,故C错误;
Cu2O+SO2↑+SO3↑+O2↑知,1molCuSO4在1100℃所得混合气体X中,O2为0.5mol,但是,由于存在三氧硫的分解平衡,无法确定产物中氧气的物质的量是多少,故C错误;
D..相对于途径①、③,途径②的优点是:制取等质量胆矾需要的硫酸少、途径2无污染性气体产生。故D正确;
答案选C。

练习册系列答案
相关题目